穩定細胞株構建的第一個步驟就是細胞轉染,這(zhè)項實驗的原理(lǐ)大(dà)家都清楚,但(dàn)是爲什(shén)麽一上(shàng)手就會(huì)出現(xiàn)多種問題,在實驗第一步就栽了(le)跟頭呢(ne)?
是細胞轉染方法不對(duì)頭?還是實驗過程中的某個因素影響了(le)轉染效率?了(le)解本文(wén)這(zhè)11個注意事(shì)項,讓你(nǐ)的細胞轉染實驗順利通關!
所謂轉染,是指在真核細胞裏導入具有生物功能(néng)的核酸并核酸的生物功能(néng)。通常選用(yòng)的轉染方法包括物理(lǐ)介導法(如電穿孔法、顯微注射和(hé)基因槍等)、化學介導法(如磷酸鈣共沉澱法、脂質體轉染方法、多種陽離子物質介導法)、生物介導法(如原生質體轉染、病毒介導轉染等)。上(shàng)述方法中,實驗室最常用(yòng)的方法當屬是脂質體轉染(質粒轉染)。
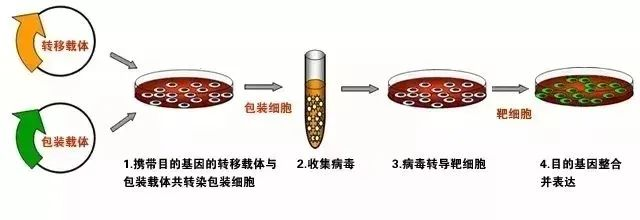
質粒轉染操作(zuò)簡單,分爲瞬時(shí)轉染和(hé)穩定轉染。針對(duì)不同屬性細胞系,選擇轉讓方式時(shí)要做足功課,千萬不要圖方便,否則轉染效率簡直崩潰。影響轉染效率的因素有很(hěn)多,比如準備不充分、轉染條件不佳;再比如細胞株本身的特性和(hé)活性、細胞污染,轉染的DNA/RNA的質量,轉染方法,轉染試劑的選擇等,小(xiǎo)編總結了(le)這(zhè)11個注意事(shì)項,一起來(lái)學習吧!
01血清條件下(xià)的細胞轉染
轉染可以使用(yòng)血清,前提是DNA-陽離子脂質體複合物形成時(shí)不含血清,否則會(huì)降低(dī)轉染效率(血清會(huì)影響複合物的形成)。
轉染用(yòng)的培養液可以含血清也(yě)可以不加,如加血清則應在DNA-陽離子脂質體複合物形成後加入,轉染培養基中加入血清需要對(duì)條件進行優化。
對(duì)于對(duì)血清缺乏比較敏感的貼壁細胞,建議(yì)使用(yòng)專用(yòng)轉染試劑。條件允許情況下(xià),可以用(yòng)無血清培養基代替PBS洗細胞兩遍,注意洗的時(shí)候要輕,靠邊緣緩緩加入液體,然後不要吹吸細胞,而是轉動培養闆讓液體滾動在細胞表面。如果洗的太厲害,細胞又損失一部分,加了(le)脂質體後,細胞受影響就更大(dà)了(le),死亡細胞會(huì)增多。
02培養基中的抗生素(PS)
抗生素(如青黴素、鏈黴素等)是影響轉染的培養基添加物。由于陽離子脂質體試劑增加了(le)細胞的通透性,使得對(duì)真核細胞無毒的抗生素進入細胞,從(cóng)而降低(dī)細胞活性,導緻轉染效率降低(dī)。因此,應避免在轉染前細胞鋪闆時(shí)和(hé)在轉染培養基中使用(yòng)抗生素,在轉染前也(yě)不必潤洗細胞。
03細胞狀态
衆所周知(zhī),細胞的生長狀态影響實驗結果,原代細胞和(hé)傳代次數多的細胞都不是最佳選擇,處于對(duì)數生長期的細胞生長狀态最好(hǎo),最适合轉染。有文(wén)獻研究傳代不要超過17代,細胞複蘇後的3代左右時(shí)細胞狀态最好(hǎo),傳代過多細胞形态都會(huì)發生變化。大(dà)多數已建立的細胞系都是非整倍體,原代培養包括了(le)表達不同基因組合的細胞的混合物。細胞培養在實驗室中保存數月和(hé)數年後會(huì)經曆突變,總染色體重組或基因調控變化等而演化。這(zhè)會(huì)導緻和(hé)轉染相關的細胞行爲的變化。如果随時(shí)間發現(xiàn)這(zhè)種變化,融化一管新鮮的細胞可能(néng)會(huì)恢複原先的轉染活性。因此,如果觀察到(dào)轉染效率降低(dī),可以試着轉染新鮮培養的細胞以恢複最佳結果。
04細胞鋪闆密度
用(yòng)于轉染的最佳細胞密度根據不同的細胞類型或應用(yòng)而異。因轉染試劑對(duì)細胞有毒害作(zuò)用(yòng),細胞太少,容易死。一般轉染時(shí),貼壁細胞密度爲70%-90%,懸浮細胞密度爲2-4×106細胞/ml,确保轉染時(shí)細胞沒有長滿或處于靜止期。因爲轉染效率對(duì)細胞密度很(hěn)敏感,所以在不同實驗間保持一個基本的傳代步驟很(hěn)重要。鋪闆細胞數目的增加可以增加轉染活性和(hé)細胞産量。細胞的融合度必須要達到(dào)90%才能(néng)做。
05啓動子的選擇
獲得高(gāo)轉染活性所需選擇的啓動子依賴于選用(yòng)的細胞系和(hé)要表達的蛋白(bái)。CMV啓動子在大(dà)多數細胞類型中可以獲得高(gāo)表達活性。同其他(tā)啓動子,如SV40和(hé)RSV(勞斯肉瘤病毒)相比,在BHK-21中其活性最高(gāo)。這(zhè)三種病毒啓動子在T細胞來(lái)源的細胞系,如Jurkat中組成表達水(shuǐ)平較低(dī)。轉染後在培養基中加入PHA-L和(hé)PMA可以激活Jurkat細胞中CMV啓動子,而單PMA就足以激活KG1和(hé)K562(人骨髓瘤白(bái)細胞)中的CMV啓動子。SV40啓動子的表達在含有大(dà)T抗原(存在于COS-1和(hé)COS-7)時(shí)會(huì)提高(gāo),因爲大(dà)T抗原可以刺激染色體外(wài)的合成。
06DNA量
高(gāo)質量的DNA對(duì)于進行高(gāo)效的轉染至關重要。轉染的質粒一定純度好(hǎo)、濃度高(gāo)、無内毒素。濃度不要低(dī)于0.35ug/ul。産物表達,48小(xiǎo)時(shí)mRNA表達最高(gāo);72h蛋白(bái)表達最高(gāo)。
07瞬時(shí)/穩定轉染表達
穩定基因表達符合長期生産需求。整個實驗操作(zuò)流程提供長期穩定及規模可調的蛋白(bái)生産。與穩定基因表達相比,瞬時(shí)表達(TGE)主要适用(yòng)于短期内制備重組蛋白(bái),普健生物的瞬時(shí)表達使用(yòng)懸浮細胞,能(néng)夠完成mL到(dào)100L的體積的蛋白(bái)表達,一般在10天内即可快(kuài)速轉染,無需質粒DNA的遺傳性選擇。
08轉染效率監測
基因的瞬時(shí)表達在24-72小(xiǎo)時(shí)内就結束了(le)。這(zhè)種快(kuài)速的瞬時(shí)表達非常适用(yòng)于驗證質粒表達和(hé)監測轉染步驟的效率。
可以使用(yòng)報(bào)告基因來(lái)确定優化條件,其表達蛋白(bái)易檢測,在目的細胞中不含此蛋白(bái)或水(shuǐ)平很(hěn)低(dī)。常用(yòng)的報(bào)告基因包括氯黴素乙酰轉移酶(CAT),綠色熒光蛋白(bái)(GFP),熒光素酶(Lux或Luc)以及b-半乳糖苷酶(b-gal)。可以使用(yòng)簡單的非同位素方法檢測b-gal的表達以測定轉染效率和(hé)活性。pCMV SPORT- bgal質粒包含CMV啓動子調控下(xià)的LacZ基因,轉染入真核細胞内後可以直接表達bgal。結合簡單的檢測步驟,可以做爲監測轉染條件的一種方便靈敏的方法。
09穩定轉染細胞系的篩選
用(yòng)載體中所含的選擇标志進行篩選是建立穩定轉染細胞系最常用(yòng)的方法。抗生素抗性基因可以與目的基因在同一個質粒上(shàng),也(yě)可以在不同的質粒上(shàng)。如果兩個不同的質粒同時(shí)轉染,兩個質粒都可能(néng)整合形成穩定轉化子。對(duì)于兩種不同質粒的共轉染,帶有目的基因的質粒和(hé)帶有篩選标記的質粒間的比例爲3:1或更高(gāo)以保證抗性克隆帶有轉染的目的基因。
10蛋白(bái)表達和(hé)培養基的選擇
哺乳動物細胞系合成可溶的、翻譯後修飾的蛋白(bái),比細菌,真菌或昆蟲細胞中表達的蛋白(bái)更有可能(néng)有生物活性。穩定轉染的細胞可以合成大(dà)量的重組蛋白(bái),而瞬時(shí)轉染細胞可以快(kuài)速表達,迅速地合成小(xiǎo)量蛋白(bái)。普健生物使用(yòng)細胞系包括CHO,HEK293,CHO-S,CHO-K1等常用(yòng)細胞系。普健生物提供克隆的HEK293,CHO-S,DG44和(hé)CHO-K1細胞,來(lái)源于經篩選轉染效率更高(gāo)的亞細胞系。這(zhè)些(xiē)細胞也(yě)可用(yòng)于無血清和(hé)限定化學成分培養基。重組蛋白(bái)的大(dà)規模生産一般在穩定轉染的懸浮細胞中進行。這(zhè)些(xiē)細胞易于生長到(dào)高(gāo)密度并合成更多蛋白(bái),使用(yòng)基質珠做爲固相支持可以使貼壁細胞懸浮生長。
11轉染效率的驗證
最有效的驗證方式必須是qPCR驗證。
熒光觀察,使用(yòng)病毒轉染,明(míng)白(bái)自(zì)己病毒的情況,是熒光标記(一般是GFP)還是非熒光标記。質粒轉染,可以在載體上(shàng)添加熒光标記,幫助自(zì)己通過熒光觀察轉染效率。但(dàn)是熒光并不能(néng)完全證明(míng)轉染效率,還是通過核酸驗證最爲準确。

 聯系我們
聯系我們





