抗微生物藥物耐藥(antimicirobial resistance,AMR)是全球公共衛生面臨的重要威脅。艱難梭菌(Clostridioides difficile,CD)是一種重要的多重耐藥菌,常對(duì)大(dà)環内酯類、林(lín)可酰胺類、四環素類、頭孢菌素類和(hé)氟喹諾酮類呈多重耐藥。該特征使得CD能(néng)夠在應用(yòng)廣譜抗菌藥物導緻腸道(dào)菌群失調時(shí)進行優勢生長、産生毒素從(cóng)而造成艱難梭菌感染(Clostridioides difficile infection,CDI),同時(shí)其産芽孢的特性可造成CD在醫(yī)療機構内的廣泛傳播。從(cóng)2013年開(kāi)始,CD就被被美(měi)國疾病控制和(hé)預防中心(Centers for Disease Control and Prevention,CDC)列爲最緊迫的公共衛生威脅,每年給美(měi)國醫(yī)療保健系統造成10億美(měi)元的損失。至2019年美(měi)國CDC仍将其納入五大(dà)抗生素耐藥性緊急威脅之一。
當前臨床上(shàng)推薦治療CDI的抗菌藥物有甲硝唑(metronidazole,MTZ)、萬古黴素(vancomycin)
和(hé)非達黴素(fidaxomicin)。除此之外(wài),有研究表明(míng)替加環素(tigecycline)可有效治療重度CDI,利福昔明(míng)(rifaximin)可能(néng)有助于預防CDI複發。然而,近年來(lái)發現(xiàn)CD對(duì)這(zhè)些(xiē)藥物的敏感性較前下(xià)降。來(lái)自(zì)美(měi)國休斯頓的一項研究結果顯示CDI患者糞便分離株中26%對(duì)萬古黴素不敏感,29%對(duì)MTZ不敏感;而在肯尼亞内羅畢進行的另外(wài)一項研究顯示對(duì)二者不敏感的分離株比例可高(gāo)達67%和(hé)85%。與此同時(shí),這(zhè)兩種藥物治療失敗的報(bào)道(dào)也(yě)并不少見。在國内,艱難梭菌不屬于CARSS和(hé)CHINET細菌耐藥監測網監測病原菌範疇,但(dàn)某些(xiē)小(xiǎo)規模流行病學研究仍然提示耐藥菌株的存在。Meta分析顯示2007~2013年間我國臨床來(lái)源艱難梭菌對(duì)利福平的耐藥率爲18.3%,對(duì)四環素的耐藥率爲46.8%,對(duì)甲硝唑和(hé)萬古黴素則完全敏感。浙江杭州兩所三甲醫(yī)院2012~2015年間腹瀉患者糞便l來(lái)源的411株艱難梭中有15.6%對(duì)甲硝唑耐藥,36.3%對(duì)四環素耐藥,所有菌株均對(duì)萬古黴素敏感,且産毒株的多重耐藥率(96.4%)遠高(gāo)于非産毒菌株(31.4%)。艱難梭菌對(duì)抗菌藥物耐藥機制是多種多樣的。
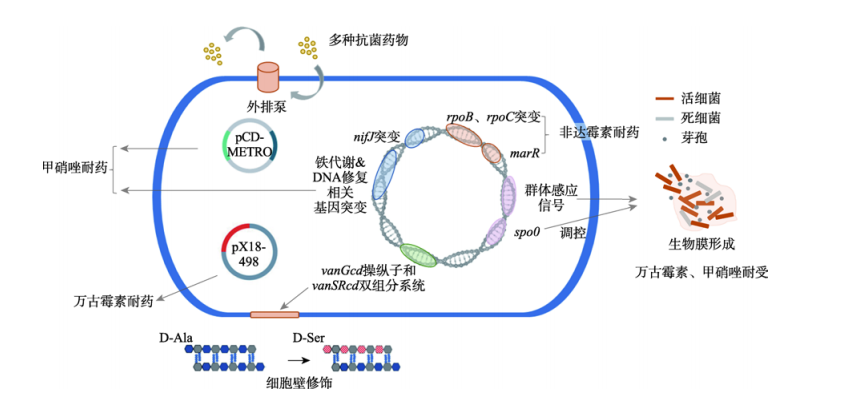
細菌對(duì)抗菌藥物主要的幾類耐藥機制在艱難梭菌中均比較常見。艱難梭菌可通過改變藥物結構造成抗菌藥物失效:例如通過轉座子Tn4453a和(hé)Tn4453b上(shàng)攜帶的catD編碼的氯黴素乙酰轉移酶,對(duì)氯黴素伯羟基進行乙酰化修飾導緻藥物失效無法與細菌50S核糖體亞基結合;此外(wài)某些(xiē)CD菌株編碼D類β-内酰胺酶可破壞β-内酰胺環使頭孢菌素類藥物失去活性。艱難梭菌還可對(duì)抗菌藥物靶點進行修飾:例如vanCd操縱子的表達可造成CD肽聚糖前體末端d-Ser修飾,使該位點與萬古黴素的親和(hé)力降低(dī)。迄今爲止,在CD臨床株RpoB利福平耐藥決定區(qū)(rifampin resistance determining region,RRDR)中也(yě)已發現(xiàn)十餘種耐藥突變,可能(néng)阻礙利福黴素類藥物與靶點RpoB蛋白(bái)的結合。艱難梭菌編碼不同家族的轉運蛋白(bái)對(duì)抗菌藥物進行主動外(wài)排:例如CD中cdeA編碼的MATE家族轉運蛋白(bái)與氟喹諾酮耐藥有關,而ABC家族轉運蛋白(bái)CprABC介導了(le)CD對(duì)抗微生物肽的抗耐藥性。生物膜的形成同樣參與了(le)艱難梭菌對(duì)藥物的耐受:亞抑菌濃度的萬古黴素和(hé)甲硝唑可增強CD生物膜的形成,同時(shí)CD生物膜又可耐受更高(gāo)濃度的甲硝唑(10~100mg/L)和(hé)萬古黴素(20mg/L)。除此之外(wài),一些(xiē)既往未考慮的機制如可轉移質粒介導的耐藥(推測編碼N-乙酰胞壁酰-L-丙氨酸酰胺酶的萬古黴素耐藥質粒pX18-498,甲硝唑耐藥質粒pCD-METRO等),同樣可能(néng)在艱難梭菌AMR中發揮重要作(zuò)用(yòng)。
甲硝唑
MTZ是硝基咪唑類抗生素,自(zì)20世紀90年代末以來(lái)一直是治療輕中度CDI的首選藥物。然而,自(zì)從(cóng)流行毒株NAP1/027出現(xiàn)後,許多國家陸續報(bào)道(dào)了(le)對(duì)MTZ低(dī)水(shuǐ)平耐藥和(hé)異質性耐藥的菌株,近年來(lái)甚至分離到(dào)高(gāo)水(shuǐ)平耐藥株。對(duì)MTZ治療響應降低(dī)的CDI病例報(bào)道(dào)也(yě)越來(lái)越多見。
MTZ是一種前體藥物,攝入菌體後,在胞内經厭(yàn)氧菌特有的低(dī)氧化還原電位酶促反應還原激活,雜(zá)環裂變後形成羟乙基肟酸和(hé)乙酰胺。MTZ的殺菌機制尚不明(míng)确,可能(néng)爲活化反應伴随生成的硝基自(zì)由基對(duì)厭(yàn)氧菌産生細菌毒性,造成細菌死亡。
CD對(duì)MTZ耐藥亦可能(néng)涉及多種機制,其一是藥物還原激活通路的改變。參與藥物氧化還原反應的電子傳遞蛋白(bái)如丙酮酸黃多辛氧化還原酶PFOR等在該酶促反應中發揮了(le)重要作(zuò)用(yòng),這(zhè)類蛋白(bái)編碼基因的突變參與了(le)耐藥形成。鐵(tiě)離子作(zuò)爲組成PFOR等電子傳遞蛋白(bái)功能(néng)性
輔基(如含鐵(tiě)硫簇)的重要元素,在MTZ還原激活途徑中發揮重要作(zuò)用(yòng),因此鐵(tiě)代謝(xiè)/穩态的變化也(yě)被認爲與CD對(duì)MTZ耐藥有關。
艱難梭菌對(duì)甲硝唑耐藥可能(néng)與甲硝唑的臨床療效下(xià)降有關。近期研究表明(míng),艱難梭菌對(duì)MTZ MIC≥1μg/mL是基于MTZ的初始治療方案臨床治療失敗的獨立預測因素。來(lái)自(zì)美(měi)國與歐洲的兩個多中心隊列RCT研顯示甲硝唑标準方案下(xià)CDI初始治療失敗率接近30%,且後續出現(xiàn)CDI複發的概率總體達到(dào)23%,兩項指标均劣于萬古黴素。因此近5年歐洲和(hé)美(měi)國指南中MTZ地位有所下(xià)降,僅推薦用(yòng)于治療不能(néng)耐受或無法獲得萬古黴素/非達黴素的輕中度CDI初次發作(zuò)患者。
萬古黴素
最常見的萬古黴素耐藥機制是van基因介導的藥物靶點修飾,造成萬古黴素與細胞壁親和(hé)力降低(dī)。van系列基因主要介導d-Lac或d-Ser兩種末端修飾。其中,d-Lac修飾(d-Ala-d-Lac)由vanA和(hé)vanB基因簇編碼,可造成高(gāo)水(shuǐ)平萬古黴素抗性;d-Ser修飾(d-Ala-d-Ser)由vanC、vanE和(hé)vanG基因簇編碼,可造成低(dī)水(shuǐ)平抗性。多藥外(wài)排泵是存在于細菌細胞膜中的主動轉運蛋白(bái),其中一個主要家族是ATP結合盒(ATPbinding cassette,ABC)轉運蛋白(bái),水(shuǐ)解ATP供能(néng),對(duì)簡單離子或大(dà)分子的溶質如抗菌藥物進行轉運外(wài)排。已有研究在幾種梭狀芽孢杆菌中證實轉運蛋白(bái)是造成多藥耐藥的主要原因。在CD中,陽離子抗菌肽(cathelicidin antimicrobial peptide,CAMP)可誘導ABC轉運蛋白(bái)操縱子高(gāo)表達,從(cóng)而降低(dī)各種CAMP的有效性。
非達黴素
窄譜抗菌藥物非達黴素與細菌RNA聚合酶(RNA polymerase,RNAP)的夾型結構域結合,抑制DNA轉錄的起始步驟。自(zì)2011年起,美(měi)國食品藥品監督管理(lǐ)局批準非達黴素用(yòng)于CDI。
非達黴素耐藥性源于RNAP結合位點的突變,包括RpoB (Gln1074Lys,Val1143Asp、Gly、Phe)和(hé) RpoC(Gln781Arg,Asp1127Glu,Asp237Tyr)等多種突變。其中,Val1143Asp (MIC>64 mg/L) 和(hé)Val1143Gly (MIC=16 mg/L)也(yě)存在于非達黴素耐藥的臨床分離CD菌株中。RpoB的 Val1143Asp突變會(huì)影響CD的适應性和(hé)毒力。Val1143Asp、Val1143Gly 突變的實驗室菌株與其親本菌株R20291相比,整體生長變緩、競争适應性下(xià)降且毒素A和(hé)B的産生均減少,在 CDI金(jīn)黃地鼠模型中其毒力也(yě)降低(dī)。
由于這(zhè)類耐藥突變伴随着适應性降低(dī),且非達黴素的窄譜活性對(duì)腸道(dào)微生物群影響較小(xiǎo),因此如果在治療過程中出現(xiàn)耐藥突變,共生的多種腸道(dào)微生物群可能(néng)有助于減輕突變帶來(lái)的影響。
利福昔明(míng)和(hé)四環素類
利福昔明(míng)抑制細菌RNA聚合酶。細菌RNA聚合酶β亞基RpoB突變是産生利福黴素抗性的主要機制。這(zhè)些(xiē)突變會(huì)破壞利福黴素和(hé)RpoB的直接相互作(zuò)用(yòng)或改變RpoB上(shàng)的利福黴素結合口袋(rifamycin-binding pocket)結構。
已發現(xiàn)CD中存在多處可造成耐藥的RpoB突變,包括Ser488Tyr,Asp492Tyr,His502Asn/Tyr,Arg505Lys,Ser550Phe/Tyr。與其他(tā)菌株不同(例如腦(nǎo)膜炎奈瑟球菌和(hé)結核分枝杆菌),RpoB突變導緻CD對(duì)利福黴素産生耐藥性的同時(shí)不會(huì)産生體外(wài)和(hé)體内适應性代價。CD對(duì)利福黴素的耐藥性發展迅速,有研究顯示甚至在利福昔明(míng)用(yòng)于CDI期間就可能(néng)出現(xiàn)耐藥,導緻臨床效果不佳。
四環素類是靶向細菌30S核糖體的廣譜抗菌藥物,可阻止氨基酰-tRNA與mRNA結合從(cóng)而抑制蛋白(bái)質翻譯。與利福昔明(míng)相比,CD對(duì)替加環素的耐藥率較低(dī)。CD通過轉座子(例如Tn916、Tn5397和(hé)Tn4453)攜帶的各種tet基因(例如tetM、tetW、tetA(P)和(hé)tetB(P))編碼的核糖體保護蛋白(bái)即延伸因子(elongationfactor),介導四環素類藥物耐藥性的産生。
随着對(duì)耐藥性變遷和(hé)耐藥機制的更好(hǎo)了(le)解,将爲抗菌藥物合理(lǐ)應用(yòng),遏制耐藥菌的産生和(hé)播散、新抗菌藥以及新耐藥菌快(kuài)速檢測試劑盒的研發提供理(lǐ)論基礎。
- Antimicrobial Resistance Collaborators. Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. Lancet, 2022, 399(10325): 629–655.
- Khoruts A, Staley C, Sadowsky MJ. Faecal microbiota transplantation for clostridioides difficile: mechanisms and pharmacology. Nat Rev Gastroenterol Hepatol, 2021, 18(1): 67–80.
- Boekhoud IM, Sidorov I, Nooij S, Harmanus C, Bos-Sanders IMJG, Viprey V, Spittal W, Clark E, Davies K, Freeman J, Kuijper EJ, Smits WK, COMBACTE-CDI Consortium. Haem is crucial for medium-dependent metronidazole resistance in clinical isolates of Clostridioides difficile. J Antimicrob Chemother, 2021, 76(7): 1731–1740.
- Zhao HL, Nickle DC, Zeng Z, Law PYT, Wilcox MH, Chen L, Peng Y, Meng J, Deng ZQ, Albright A, Zhong HZ, Xu X, Zhu SD, Shen JD, Blanchard RL, Dorr MB, Shaw PM, Li JH. Global landscape of clostridioides difficile phylogeography, antibiotic susceptibility, and toxin polymorphisms by post-hoc whole-genome sequencing from the MODIFY I/II studies. Infect Dis Ther, 2021, 10(2): 853–870.

 聯系我們
聯系我們





