糖基化修飾在藥物蛋白(bái)功能(néng)、穩定性及血漿半衰期等方面起到(dào)重要作(zuò)用(yòng)。真核生物中糖基化修飾蛋白(bái)在維持蛋白(bái)穩定、細胞信号轉導、免疫調控、細胞間的互作(zuò)、細菌-宿主識别互作(zuò)等過程中發揮着重要功能(néng)。
N-糖基化修飾是蛋白(bái)糖修飾的主要方式之一,寡糖通過與新生肽鏈中特定天冬酰胺的酰胺氮連接。在原核生物中也(yě)廣泛存在寡糖合成途徑與 N-糖基化修飾蛋白(bái)質機制,形成病原菌外(wài)膜上(shàng)的脂寡糖。脂寡糖在病原菌黏附和(hé)宿主細胞侵入、逃避宿主免疫防禦中發揮重要作(zuò)用(yòng)。
大(dà)腸埃希菌是人體不可缺少單細胞生物。大(dà)腸埃希菌,俗名大(dà)腸杆菌(革蘭氏陰性短杆菌),周身鞭毛,能(néng)運動,無芽。是人和(hé)動物腸道(dào)中的正常栖居菌。
2002 年,瑞士聯邦理(lǐ)工(gōng)學院Wacker 等研究人員首次将空(kōng)腸彎曲杆菌( Campylobacter jejuni) N-糖基化基因簇( pgl) 轉入大(dà)腸杆菌,成功地在大(dà)腸杆菌工(gōng)程菌株中N-糖基化修飾外(wài)源蛋白(bái)質,開(kāi)創了(le)利用(yòng)大(dà)腸杆菌 N-糖基化修飾重組蛋白(bái)新紀元。近 20 年間,人們利用(yòng)不同來(lái)源的糖基化轉移酶、寡糖轉移酶,在大(dà)腸杆菌中開(kāi)展類人源和(hé)人源化 N-糖基化重組蛋白(bái)、病原菌寡糖的糖疫苗制備研究。
利用(yòng)大(dà)腸杆菌表達系統制備N-糖基化重組蛋白(bái)的機制
天然原核生物 N-糖基化修飾系統主要由4個必要元件組成:糖基化識别序列、糖基轉移酶
(glycosyl transferase,GT) 、糖苷酶、糖底物供體,它們分别負責接受、添加、修剪和(hé)提供底物以合成寡糖,并進一步通過依賴寡糖轉移酶( oligosaccharyl transferase,OST) /非依賴 OST的途徑将寡糖轉移到(dào)靶蛋白(bái)上(shàng)。将以上(shàng)機制轉移到(dào)大(dà)腸杆菌中,實現(xiàn) N-糖基化重組蛋白(bái),可重塑合成寡糖鏈及重組蛋白(bái)修飾,将在糖疫苗生産、糖基化修飾藥物蛋白(bái)等方面具有巨大(dà)應用(yòng)潛力。
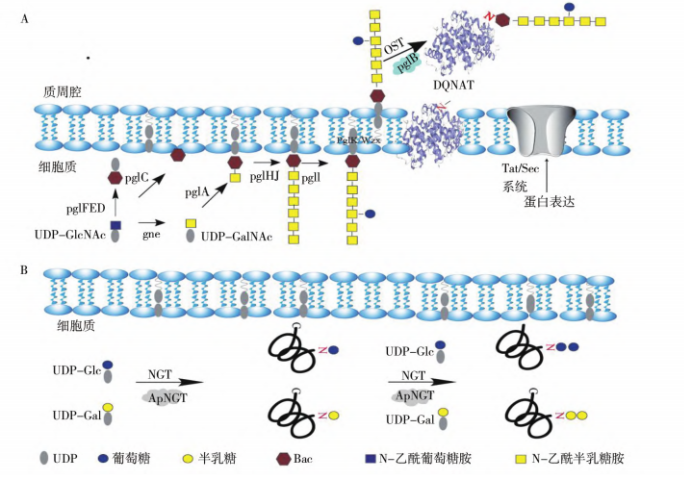
Schematic diagram of the main mechanism of N-glycosylated recombinant protein production via Escherichia coli
A: OST-dependent N-glycosylation system; B: OST-independent N-glycosylation system
應用(yòng)大(dà)腸杆菌表達系統制備N-糖基化重組蛋白(bái)
利用(yòng)大(dà)腸杆菌表達系統生産糖基化基因工(gōng)程抗體等重組蛋白(bái)及糖疫苗是目前熱點研究方向。自(zì)2012 年Aebi課題組首次利用(yòng)大(dà)腸杆菌實現(xiàn)類人源化糖鏈Man3GlcNAc2核心五糖 N-糖基化修飾重組蛋白(bái)後,利用(yòng)多種原核生物進行糖基化修飾的技術一直在不斷探索中,其技術核心是将其他(tā)原核生物來(lái)源的寡糖轉移酶(識别并将寡糖轉移到(dào)重組蛋白(bái)上(shàng)的糖基化識别序列上(shàng))和(hé)多種糖基轉移酶(非模闆驅動合成寡糖)在大(dà)腸杆菌中共表達,完成寡糖合成及 N-糖基化定點修飾蛋白(bái)基本過程。
近幾年研究結果表明(míng)該系統可以實現(xiàn)定點(識别特異氨基酸序列)、均質性(糖鏈微觀均質、糖蛋白(bái)宏觀均質)修飾重組蛋白(bái),這(zhè)是真核系統無法比拟的優勢。真核細胞合成的聚糖性質較其他(tā)合成途徑而言與人的更爲相似(如圖)。但(dàn)是,天然真核細胞表達系統糖表位修飾N-糖基化重組蛋白(bái)的均質性很(hěn)低(dī),這(zhè)種異質性源于哺乳動物複合型N-多糖合成的多步驟過程。
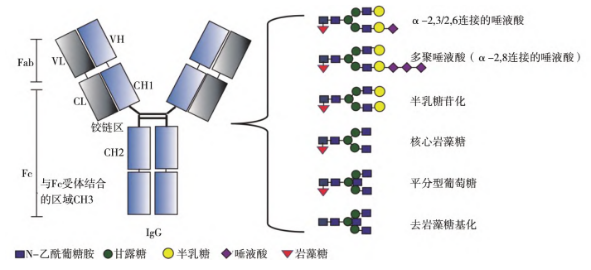
Schematic diagram of antibody glycosylation modification in eukaryotic cells
普健生物擁有十餘年的蛋白(bái)表達經驗,經過不斷的探索和(hé)改進,開(kāi)發了(le)建立了(le)3H(High through、High efficiency、High quality)大(dà)腸杆菌表達系統,擁有獨特的表達純化及複性平台,95%以上(shàng)的超高(gāo)蛋白(bái)表達成功率,已成功交付上(shàng)萬例大(dà)腸杆菌表達服務項目。如果您有大(dà)腸杆菌重組蛋白(bái)表達與純化項目需求,歡迎聯系027-87001869與我們的專員進行溝通!
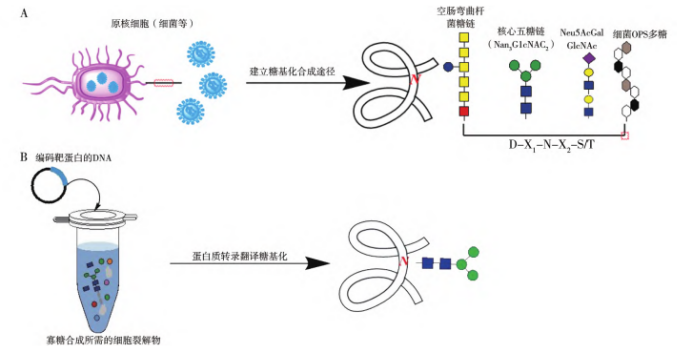
Schematic diagram of the production of N-glycosylated recombinant proteins using Escherichia coli
A: Recombinant protein pathway modified by N-glycosylation in Escherichia coli; B: Cell-free glycoprotein synthesis pathway
O-糖基化修飾可以增加治療性蛋白(bái)的穩定性和(hé)體内循環時(shí)間。雖然糖基化修飾對(duì)每種蛋白(bái)質的影響可能(néng)不同,但(dàn)研究顯示N-糖基化修飾可通過以下(xià)方式改善蛋白(bái)的理(lǐ)化性質:
①通過屏蔽非結構化、疏水(shuǐ)性或易于蛋白(bái)酶作(zuò)用(yòng)的蛋白(bái)質區(qū)域來(lái)防止變性、聚集和(hé)降解;
②增加分子的分子量和(hé)流體動力學半徑以減少腎濾過;
③去除免疫原性,減少免疫系統清除;
④覆蓋或去除可被人凝集素識别/清除的末端結構。
目前,利用(yòng)大(dà)腸埃希菌解決了(le)均質性修飾N-糖基化修飾重組蛋白(bái)問題。該技術有望首先在糖疫苗生産方面得到(dào)産業化應用(yòng)。
參考文(wén)獻
[1]Wacker M,Linton D,Hitchen PG,et al.N-Linked glycosylation in Campylobacter jejuni and its functional transfer into E.Coli[J].Science,2002,298( 5599) : 1790-1793.
[2]Kightlinger W,Warfel KF,Delisa MP,et al.Synthetic glycobiology: Parts,systems,and applications[J]. ACS Synthetic Biology,2020,9(7) : 1534-1562.
[3]Pratama F,Linton D,Dixon N.Genetic and process engineering strategies for enhanced recombinant N-glycoprotein production in bacteria[J].Microbial Cell Factories,2021,20( 1) : 198.
[4]Terra VS,Mauri M,Sannasiddappa TH,et al.PglB function and glycosylation efficiency is temperature dependent when the pgl locus is integrated in the Escherichia coli chromosome[J].Microbial Cell Factories,2022,21( 1) : 6.
[5]Marshall LE,Nelson M,Davies CH,et al.An O-antigen glycoconjugate vaccine produced using protein glycan coupling technology is protective in an inhalational rat model of tularemia[J].Journal of Immunology Research,2018,2018: 8087916.
[6]Cuccui J,Thomas RM,Moule MG,et al.Exploitation of bacterial N-Linked glycosylation to develop a novel recombinant glycoconjugate vaccine against Francisella tularensis[J].Open Biology,2013,3( 5) : 130002.

 聯系我們
聯系我們





