相比傳統小(xiǎo)分子藥物,重組蛋白(bái)藥物具有高(gāo)活性、高(gāo)特異性和(hé)低(dī)毒性等多種獨特優勢,但(dàn)囿于機體内蛋白(bái)水(shuǐ)解、腎髒消除、肝髒代謝(xiè)以及免疫清除等影響,往往導緻重組蛋白(bái)藥物的體内半衰期短,使用(yòng)受限。
當藥物進入系統時(shí),由各種酶引起的代謝(xiè),尤其是多種形式的蛋白(bái)水(shuǐ)解酶的作(zuò)用(yòng),可導緻藥物降解爲小(xiǎo)分子肽或者氨基酸。這(zhè)類酶廣泛存在于胃、腸道(dào),其分布具有細胞組織的特異性。非蛋白(bái)酶因素的影響來(lái)源于蛋白(bái)質物理(lǐ)或化學上(shàng)的變化。物理(lǐ)變化包括聚合、沉澱;化學變化包括氨基酸殘基的修飾,主要有氧化作(zuò)用(yòng)、還原作(zuò)用(yòng)、脫酰胺反應、水(shuǐ)解反應、β消除、二硫化物交換等幾種反應,并且蛋白(bái)質在構建中的穩定性和(hé)免疫原性以及導緻蛋白(bái)質化學結構錯誤變化的環境條件也(yě)被認爲是影響蛋白(bái)質代謝(xiè)穩定性的主要因素。較大(dà)的多肽常通過受體介導的方式來(lái)清除,有不少例子顯示,受體介導的清除可能(néng)是一種主要的清除機制。
基于以上(shàng)的清除機制,延長蛋白(bái)半衰期的策略主要分爲保護酶解識别位點的結構改造策略、改善蛋白(bái)理(lǐ)化性質的天然或人工(gōng)多聚物修飾策略以及降低(dī)免疫原性的碳水(shuǐ)化合物修飾策略等。
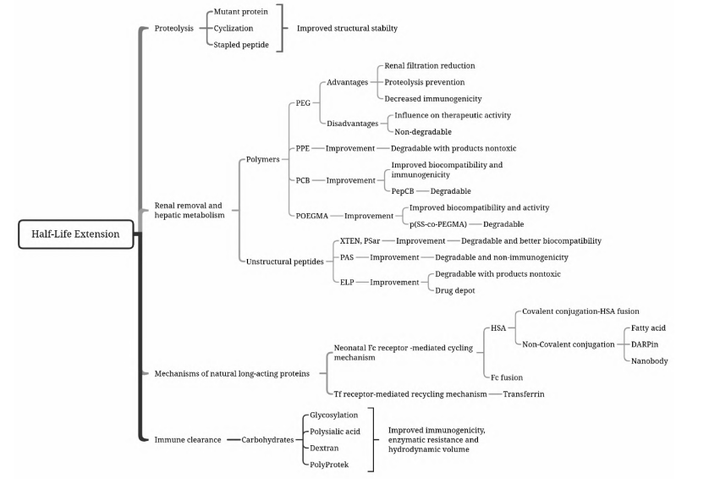
Half-life extension strategies for therapeutic proteins and peptides
普健生物擁有專業的技術團隊,在蛋白(bái)表達領域有着15年的經驗,近20000+重組蛋白(bái)表達與純化經驗。爲您提供六種高(gāo)效蛋白(bái)表達系統:大(dà)腸杆菌表達系統,枯草芽孢杆菌表達系統,酵母表達系統,昆蟲表達系統,哺乳表達系統,二硫鍵活性原核表達系統。普健生物專注于重組蛋白(bái)的表達,蛋白(bái)可溶性表達成功率在90%以上(shàng)。如果您有高(gāo)效長效蛋白(bái)表達需求,歡迎聯系027-87001869與我們的專員進行溝通!
重組蛋白(bái)藥物的發展趨勢有以下(xià)兩個特點:
第一,哺乳動物細胞作(zuò)爲表達體系的比例增加。原因在于,原核表達系統(如大(dà)腸杆菌E. coli),适合分子量較小(xiǎo)、不需要翻譯後修飾的非糖基化蛋白(bái)(如胰島素、生長激素、幹擾素和(hé)白(bái)細胞介素等);而哺乳動物細胞表達系統可進行複雜(zá)的翻譯後修飾(如蛋白(bái)質折疊、糖基化和(hé)二硫鍵的形成),表達的蛋白(bái)質與天然蛋白(bái)質更爲接近,且能(néng)通過控制翻譯後修飾實現(xiàn)預期功效。
第二,長效化重組蛋白(bái)的進展較大(dà)。利用(yòng)化學修飾、基因工(gōng)程技術等對(duì)蛋白(bái)質藥物進行改造或修飾,解決大(dà)分子蛋白(bái)質藥物血液中半衰期短、給藥途徑單一、免疫原性和(hé)毒副反應等問題,增強藥物活性、提高(gāo)藥效等,是近年來(lái)生物技術藥物發展的趨勢。長效蛋白(bái)質生物制劑技術的研究一直是大(dà)分子蛋白(bái)質藥物的研究熱點,國際上(shàng)許多大(dà)公司紛紛開(kāi)展蛋白(bái)質藥物長效制劑的開(kāi)發研究,搶占核心技術的制高(gāo)點。
重組蛋白(bái)藥物長效化技術常用(yòng)化學修飾、突變體構建、蛋白(bái)融合、糖基化等策略。化學修飾如聚乙二醇(polyethyleneglycol,PEG)修飾、聚磷酸酯(PPE)修飾、聚羧基甜菜堿(Poly( carboxybetaine),PCB)修飾、多聚唾液酸(Polysialition,PSA)、脂肪酸修飾等。它們通過化學的方法将蛋白(bái)質藥物與大(dà)分子親水(shuǐ)修飾劑進行共價偶聯的方法。共價連接到(dào)大(dà)分子上(shàng)能(néng)減小(xiǎo)免疫原性,改善可溶性和(hé)生物學利用(yòng)度,以及增加抗蛋白(bái)水(shuǐ)解作(zuò)用(yòng),同時(shí)也(yě)能(néng)夠延長半衰期。
構建突變體是将蛋白(bái)分子一個位點或多個位點進行突變,以期改善蛋白(bái)穩定性,提高(gāo)親和(hé)力或活性,降低(dī)免疫原性等,是蛋白(bái)藥物設計(jì)的一個重點方向。
蛋白(bái)融合也(yě)被認爲是天然蛋白(bái)修飾,包括Fc融合蛋白(bái)和(hé)人血清白(bái)蛋白(bái)融合蛋白(bái)。Fc融合蛋白(bái)是指利用(yòng)基因工(gōng)程等技術将某種具有生物學活性的功能(néng)蛋白(bái)分子與Fc片段融合而産生的新型蛋白(bái)質,功能(néng)蛋白(bái)可以是能(néng)結合内源性受體(或配體)的可溶性配體(或受體)分子或其他(tā)需要延長半衰期的活性物質(如細胞因子)。Fc融合蛋白(bái)大(dà)大(dà)增加活性蛋白(bái)或多肽的分子量,降低(dī)腎小(xiǎo)球的濾過率,而FcRn (Neonatal Fc receptor,新生兒Fc受體)介導的再循環機制可以避免蛋白(bái)降解,有效延長半衰期。
Fc融合蛋白(bái)的發展分爲兩個階段:第一階段,對(duì)于小(xiǎo)分子肽通過表達二聚體融合蛋白(bái)實現(xiàn)延長藥物的半衰期(例如禮來(lái)糖尿病藥物Trulicity);第二階段,對(duì)于分子量大(dà)于30 kDa的大(dà)分子蛋白(bái)使用(yòng)二聚體Fc和(hé)單體蛋白(bái)策略。作(zuò)爲目前最爲成功的蛋白(bái)長效化手段之一,目前已有10多種批準上(shàng)市的Fc融合蛋白(bái)藥物。
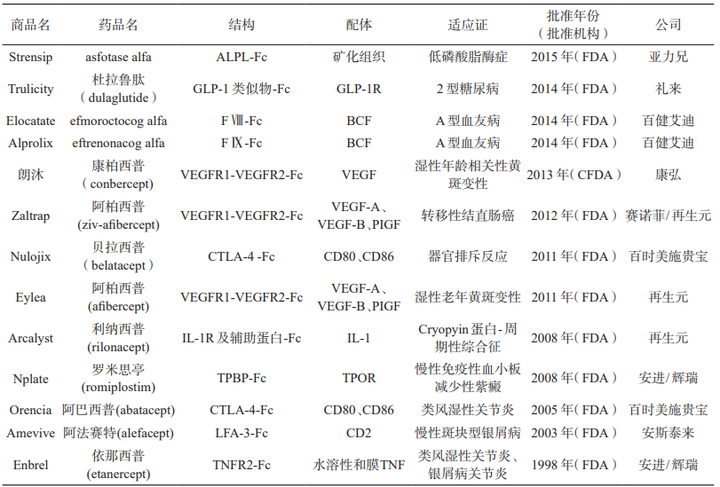
已上(shàng)市的重組 Fc 融合蛋白(bái)類藥物
人血清白(bái)蛋白(bái)( Human serum albumin,HSA) 是血漿中含量最高(gāo)的蛋白(bái)質,相對(duì)分子質量66500,半衰期約19 d。作(zuò)爲一種長效的天然蛋白(bái),其長效機制在于HSA在弱酸性的溶酶體( pH6.0) 環境中可通過結構域III結合FcRn,随後通過FcRn的跨膜作(zuò)用(yòng)被重新轉運至血液,并在中性血液中( pH7.4) 被釋放(fàng),避免了(le)溶酶體的降解作(zuò)用(yòng)。作(zuò)爲天然蛋白(bái),HAS 還具有親水(shuǐ)穩定、安全無毒等優點,藥物可以通過基因融合或共價修飾的方式直接結合,也(yě)可以通過結合 HSA配體與其非共價結合,因此 HSA 可作(zuò)爲理(lǐ)想的天然修飾物。
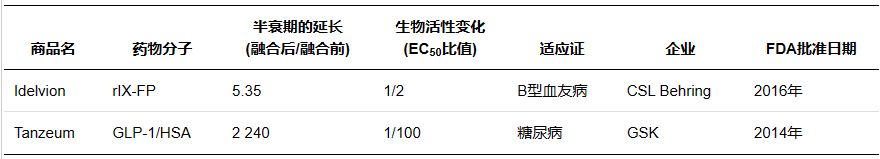
Marketed albumin fusion proteins
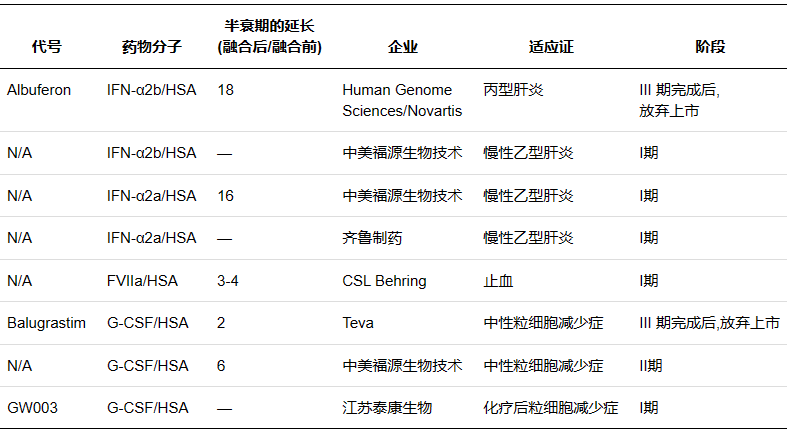
Albumin fusion proteins in clinical development
蛋白(bái)質的糖基化(Glycosylation)是真核生物的一種常見翻譯後修飾方式,是某些(xiē)蛋白(bái)質發揮生物活性所必需的。蛋白(bái)質表面的糖鏈能(néng)夠影響蛋白(bái)質的藥物動力學作(zuò)用(yòng)、生物活性、穩定性、對(duì)蛋白(bái)酶的易感性、水(shuǐ)溶性、凝集性、免疫原性等。因此糖基化修飾也(yě)是延長半衰期的常用(yòng)手段。
具體說來(lái),糖基化可分爲N-糖基化與O-糖基化。N-糖基化是指聚糖通過糖苷酰胺連接在 Asn-X-Ser/Thr共有序列中Asn殘基的側鏈上(shàng),工(gōng)程上(shàng)N-糖基化通常通過引入Asn-X-Ser/Thr序列,增加N-糖基化位點完成。O-糖基化則是聚糖通過O-糖苷鍵連接到(dào)Ser側鏈或Thr的羟基上(shàng)。
需要說明(míng)的是,作(zuò)爲典型的翻譯後修飾手段,糖基化修飾往往需要通過工(gōng)程化哺乳動物細胞完成,修飾糖的種類、數量、分子大(dà)小(xiǎo)、序列和(hé)電荷等因素對(duì)于藥物理(lǐ)化性質和(hé)生物活性的影響複雜(zá)而特異,并有助于提高(gāo)藥物的靶向性。然而由于糖基化可控性低(dī),因此糖基化藥物在應用(yòng)上(shàng)仍面臨着産率低(dī)、控制困難等技術挑戰。
參考文(wén)獻
[1] Haris B,Saraswathi S,Hussain K.Somatostatin analogues for the treatment of hyperinsulinaemic hypoglycaemia[J].Ther Adv Endocrinol Metab,2020,11: 1-23.
[2] Pairawan S,Zhao M,Yuca E,et al.First in class dual MDM2/MDMX inhibitor ALRN-6924 enhances antitumor efficacy of chemotherapy in TP53 wild-type hormone receptor-positive breast cancer models[J].Breast Cancer Res,2021,23( 1) : 23-29.
[3] Zaman R,Islam R,Ibnat N,et al.Current strategies in extending half-lives of therapeutic proteins[J].J Control Release,2019,301: 176-189.
[4] Kinstler OB, Gabriel NE, Farrar CE, et al. N-terminally chemically modified protein compositions and methods: US, 7090835. 2006-08-15.
[5] Ilyushin DG, Smirnov IV, Belogurov AA, et al. Chemical polysialylation of human recombinant butyrylcholinesterase delivers a long-acting bioscavenger for nerve agents in vivo. Proc Natl Acad Sci USA, 2013, 110(4): 1243–1248. DOI: 10.1073/pnas.1211118110
[6] Rogers B,Dong D,Li Z.Recombinant human serum albumin fusion proteins and novel applications in drug delivery and therapy.Curr Pharm Des, 2015,21(14):1899-1907.

 聯系我們
聯系我們





