線粒體是由原核生物α-變形菌進化而來(lái)的存在于大(dà)多數真核細胞中的一種功能(néng)多樣的細胞器,由線粒體外(wài)膜和(hé)内膜、線粒體膜間隙、線粒體内膜嵴以及線粒體基質五種不同結構組成。線粒體是真核細胞代謝(xiè)和(hé)合成的中心,也(yě)是動物細胞中除細胞核之外(wài)唯一攜帶基因組的細胞器。
mtDNA是一個環狀DNA,能(néng)編碼氧化磷酸化複合物形成所需的13種蛋白(bái)質、22種轉運RNA和(hé)2種線粒體RNA翻譯所需的核糖體RNA。作(zuò)爲細胞能(néng)量代謝(xiè)和(hé)合成的中心,線粒體通過氧化磷酸化過程産生ATP以維持細胞内能(néng)量穩态,同時(shí)代謝(xiè)中間産物則是生物合成途徑的重要參與者。此外(wài),線粒體通過釋放(fàng)mtDNA、mtROS和(hé)代謝(xiè)産物等參與調節包括細胞能(néng)量代謝(xiè)、細胞命運決定和(hé)免疫反應在内的多種細胞生物學過程。越來(lái)越多的研究也(yě)表明(míng)線粒體功能(néng)障礙與包括自(zì)身免疫性疾病在内的多種疾病發生有關,而且功能(néng)異常的線粒體是細胞惡性轉化的驅動力。
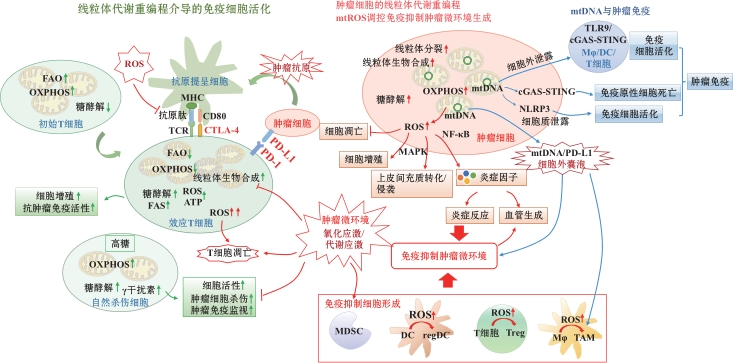
腫瘤微環境中包括腫瘤細胞和(hé)免疫細胞在内的多種細胞的線粒體功能(néng)異常是癌症發生、發展和(hé)轉移的重要原因。爲此,來(lái)自(zì)浙江大(dà)學生命科學研究院、溫州大(dà)學生命與環境科學學院等機構的研究人員圍繞線粒體生物學與抗腫瘤免疫應答(dá)之間的關系闡明(míng)了(le)線粒體在腫瘤-宿主互作(zuò)中的核心作(zuò)用(yòng),爲開(kāi)發靶向線粒體的抗腫瘤免疫治療策略提供了(le)深入見解。
線粒體調控免疫細胞活化、增殖和(hé)分化
不同種類和(hé)不同表型的免疫細胞具有特定的代謝(xiè)需求,其活化狀态受到(dào)多條信号通路調控。線粒體動力學和(hé)能(néng)量代謝(xiè)途徑變化在免疫細胞活化、增殖和(hé)分化過程中發揮至關重要的作(zuò)用(yòng)。初始T細胞的線粒體形态多爲碎片化和(hé)圓球狀,氧化磷酸化和(hé)脂肪酸氧化是維持其靜止狀态下(xià)能(néng)量需求的主要途徑。而當T淋巴細胞被激活時(shí),有氧糖酵解和(hé)脂肪酸合成相關信号活性顯著增加,從(cóng)而維持其增殖和(hé)分化能(néng)力并促進其發揮相應的生物學功能(néng);同時(shí)線粒體在T細胞受體簇下(xià)方聚集,活化的T細胞受體通過上(shàng)調鈣調磷酸酶活性活化動力蛋白(bái)相關蛋白(bái)1(Drp1),并誘導線粒體進一步分裂和(hé)線粒體内膜嵴松弛以調控效應T細胞活化調控作(zuò)用(yòng)。此外(wài),線粒體在T細胞信号轉導和(hé)細胞命運決定過程中同樣發揮重要作(zuò)用(yòng)。T淋巴細胞活化過程中,線粒體在T淋巴細胞和(hé)抗原提呈細胞形成的免疫突觸中積累,T細胞受體活化刺激線粒體生成活性氧和(hé)ATP,在維持鈣離子穩态和(hé)調控其下(xià)遊相關信号活化中至關重要。而當活化的T細胞向記憶T細胞或調節性T細胞發展時(shí),線粒體則從(cóng)分裂狀态逐漸融合形成長管狀結構,線粒體内膜嵴變得緊密,随後細胞代謝(xiè)狀态轉向脂肪酸氧化和(hé)氧化磷酸化,以維持細胞表型、存活和(hé)功能(néng)轉變。
在腫瘤微環境中,腫瘤浸潤性T細胞長期處于高(gāo)度氧化應激狀态,由于葡萄糖和(hé)氧氣缺乏環境介導的代謝(xiè)不足和(hé)Akt1-PGC1α信号介導的線粒體功能(néng)和(hé)質量持續損傷,其細胞增殖能(néng)力、生物膜結構完整性和(hé)相關信号通路活化水(shuǐ)平受到(dào)嚴重影響,T淋巴細胞抗腫瘤免疫效應和(hé)相關細胞因子産生遭到(dào)嚴重破壞,最終引發免疫抑制和(hé)腫瘤免疫逃逸。
在低(dī)氧腫瘤微環境中,腫瘤浸潤NK細胞的線粒體形态相較于正常NK細胞呈現(xiàn)出顯著的碎片化分裂狀态,NK細胞活性和(hé)腫瘤殺傷能(néng)力明(míng)顯降低(dī)并喪失腫瘤免疫監視(shì)能(néng)力。
線粒體DNA在抗腫瘤免疫中的作(zuò)用(yòng)
線粒體基因組突變是癌症突變基因組的重要組成部分,mtDNA功能(néng)障礙和(hé)基因突變與癌症的發生密切相關。mtDNA作(zuò)爲細胞内常見的DAMP,其斷裂和(hé)釋放(fàng)也(yě)是線粒體功能(néng)障礙介導機體炎症發生的關鍵因素;功能(néng)障礙線粒體通過MDV,将線粒體成分擠入細胞外(wài)囊泡,對(duì)細胞器穩态具有重要的調控作(zuò)用(yòng);氧化的mtDNA通過MDV進入内體-溶酶體途徑,并通過外(wài)泌體進入細胞外(wài)空(kōng)間,觸發多種炎症和(hé)抗炎調節途徑,從(cóng)而引發相關免疫反應。
在腫瘤微環境中,mtDNA的細胞外(wài)洩露主要由外(wài)泌體、微泡和(hé)凋亡小(xiǎo)體組成的細胞外(wài)囊泡所介導,mtDNA能(néng)夠通過直接接觸或者MDV進入細胞外(wài)囊泡,随後由囊泡運輸進入細胞外(wài)空(kōng)間,在細胞死亡過程中,mtDNA能(néng)夠通過機械性損傷介導的細胞膜破裂被動釋放(fàng)到(dào)細胞外(wài)。
當mtDNA完整性、複制和(hé)損傷修複異常導緻mtDNA洩露時(shí),細胞質定位的DNA識别受體cGAS能(néng)迅速識别mtDNA并誘導第二信使2´3´-cGAMP生成,随後2´3´-cGAMP通過激活内質網定位的接頭蛋白(bái)STING介導下(xià)遊Ⅰ型幹擾素信号通路和(hé)相關炎症反應活化。洩露到(dào)細胞外(wài)的mtDNA還可以通過激活臨近免疫細胞的TLR9和(hé)cGAS-STING信号參與包括巨噬細胞、樹突狀細胞和(hé)T淋巴細胞在内的多種免疫細胞的極化和(hé)功能(néng)調控。
此外(wài),caspase依賴的細胞凋亡是一個免疫沉默的過程。在細胞凋亡過程中,線粒體外(wài)膜通透化的形成能(néng)夠誘導細胞自(zì)噬并通過内體溶酶體途徑清除受損線粒體,從(cóng)而減弱mtDNA介導的免疫信号響應。通過調控caspase和(hé)細胞自(zì)噬活性推動由mtDNA-幹擾素信号介導的免疫原性細胞死亡可增強宿主抗腫瘤免疫響應。
線粒體活性氧在腫瘤免疫逃逸中的關鍵調控作(zuò)用(yòng)
細胞氧化應激是指細胞由于遭受有害刺激或發生劇(jù)烈的代謝(xiè)改變,細胞内高(gāo)活性分子如活性氧自(zì)由基産生過多,氧化與抗氧化系統失衡,從(cóng)而導緻細胞損傷的過程。線粒體是細胞内最主要的活性氧生成細胞器,通過有氧呼吸中的電子傳遞鏈和(hé)氧化磷酸化過程産生活性氧。生理(lǐ)條件下(xià),低(dī)水(shuǐ)平的活性氧作(zuò)爲細胞信号轉導的重要調控分子,參與調控基因表達、細胞增殖、分化和(hé)應激反應等多種細胞生命活動,但(dàn)細胞内活性氧水(shuǐ)平過高(gāo)則會(huì)造成核質和(hé)線粒體DNA、蛋白(bái)質和(hé)脂質的氧化損傷,并最終導緻細胞損傷。相較于正常細胞,腫瘤細胞往往攜帶更多活性氧,包括促癌基因激活、腫瘤抑制功能(néng)喪失、線粒體活性改變和(hé)組織炎症在内的多個促腫瘤事(shì)件均會(huì)導緻活性氧過量生成,而活性氧介導的氧化應激反應又會(huì)進一步推動炎症、纖維化和(hé)腫瘤等疾病的病理(lǐ)進程。活性氧作(zuò)爲腫瘤發生的重要媒介,在腫瘤細胞增殖、遷移和(hé)侵襲,以及血管生成、炎症和(hé)免疫逃逸等不同方面均有重要調控作(zuò)用(yòng),幫助腫瘤細胞适應嚴峻的生存環境,且其介導的炎症反應還可以改變腫瘤微環境中免疫細胞組成,影響微環境的免疫抑制性。
線粒體能(néng)量代謝(xiè)和(hé)生物合成在免疫細胞的活化過程中發揮關鍵調控作(zuò)用(yòng),而腫瘤細胞競争性消耗葡萄糖和(hé)腫瘤缺氧微環境則會(huì)通過介導線粒體損傷和(hé)活性氧大(dà)量生成,導緻免疫細胞長期處于代謝(xiè)不足和(hé)高(gāo)氧化應激環境,破壞免疫細胞的活化及其腫瘤免疫監視(shì)功能(néng),從(cóng)而獲得腫瘤免疫逃逸功能(néng)。靶向mtDNA,将代謝(xiè)療法和(hé)免疫檢查點結合或可成爲一種很(hěn)有前途的癌症治療策略。
參考文(wén)獻
Jing LI, Pinglong XU, Shasha CHEN,et al.Research progress on mitochondria regulating tumor immunity.Journal of Zhejiang University (Medical Sciences) , Volume 53, Issue 1: 1 - 14 (2024)
轉載說明(míng):本文(wén)圖文(wén)源自(zì)Journal of Zhejiang University Medical Sciences,僅做學術分享使用(yòng);感謝(xiè)每一位作(zuò)者的辛苦付出與創作(zuò),除轉載衆多無法溯源的文(wén)章,我們均在文(wén)章中備注了(le)來(lái)源。如轉載涉及版權等問題,請(qǐng)聯系我們删除,非常感謝(xiè)!

 聯系我們
聯系我們





