活化的T細胞核内因子(Nuclear Factors of activated T cells,NFAT)是一類轉錄因子家族,最初是在活化的T細胞中作(zuò)爲一種能(néng)夠結合在人白(bái)介素-2(Interleukin-2,IL-2)的啓動子上(shàng)的快(kuài)速誘導其表達的轉錄因子而被發現(xiàn)。NFAT在多種動物組織和(hé)細胞中廣泛表達,是細胞内多條信号轉導通路的關鍵調節點,在免疫系統、神經系統發育、軸突生長以及神經系統疾病中也(yě)發揮着重要作(zuò)用(yòng)。
NFAT蛋白(bái)的基本結構
目前已知(zhī)的NFAT家族包括5個成員,即NFAT1(又稱NFATe2,NFATp),NFAT2(又稱NFATc1,NFATc),NFAT3(又稱NFATc4),NFAT4(又稱NFATc3,NFATx)和(hé)NFAT5(又稱爲tonicity enhancer binding protein,TonEBP)。除了(le)在免疫系統如脾髒、外(wài)周淋巴系統廣泛表達以外(wài),NFAT蛋白(bái)幾乎在所有的組織中都有表達但(dàn)是表達水(shuǐ)平存在很(hěn)大(dà)區(qū)别,如NFATI在胰腺、睾丸、胎盤,腦(nǎo)部的下(xià)丘腦(nǎo)、海馬、小(xiǎo)腦(nǎo)、嗅球、額葉皮質中有大(dà)量表達;NFAT2主要在心血管系統和(hé)消化系統中含量較多,腎髒中也(yě)有表達;NFAT3的表達更加均衡,還會(huì)存在于脂肪組織、心肌、卵巢、脊髓、大(dà)腦(nǎo)等區(qū)域;NFAT4 則存在于骨骼肌和(hé)平滑肌,肺,下(xià)丘腦(nǎo)及紋狀體中。
NFAT家族發現(xiàn)的十幾種NFAT蛋白(bái)中,除了(le)非保守的C端以外(wài),都具有2個相鄰的非常保守的區(qū)域,即NFAT同源區(qū)(NFAT homology region,NHR),主要與NFAT的轉錄調節有關;Rel同源結構域( Rel-homology domain,RHD)主要參與NFAT 與 DNA 的結合。
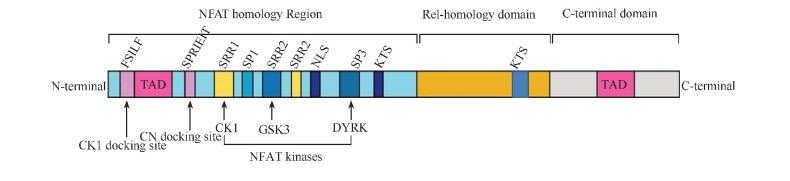
NFAT轉錄活性的主要調節方式是磷酸化/去磷酸化。NHR中含有多個保守的結構單元,如富含絲氨酸的結構SRR1和(hé)SRR2(serine-rich region,SRRs)和(hé)富含絲氨酸脯氨酸的結構SP1、SP2和(hé)SP3(serine-proline region,SPs),這(zhè)些(xiē)結構都能(néng)夠被NFAT的激酶磷酸化,如酪蛋白(bái)激酶(casein kinase 1,CK1),糖原合成激酶3(glycogen synthase kinase 3,GSK-3)和(hé)酪氨酸磷酸化調節激酶(dual-specificity tyrosine-phosphorylation-regulated kinase,DYRK)等。
NHR中還含有鈣調神經磷酸酶的結合基序SPRIEIT,CK1結合基序FSILF,更爲重要的是1個被掩蓋的核定位序列(nuclear localization signal,NS)。非激活狀态下(xià)NFAT的Ser殘基處于磷酸化狀态,形成一種掩蔽NIS的構象,而這(zhè)些(xiē)Ser殘基的去磷酸化則會(huì)導緻NIS的激活。SPRIEIT基序的缺失或其中的Ser發生突變都會(huì)導緻NFAT組成型核定位,而NS的缺失或突變則會(huì)導緻NFAT不能(néng)發生核定位。值得一提的是,RHD區(qū)域也(yě)含有1個NS,也(yě)會(huì)受到(dào)磷酸化Ser殘基的掩蔽影響,從(cóng)而與NHR中的NLS共同調控NFAT的核定位。
RHD區(qū)域主要負責NFAT與DNA的結合及與AP-1( activator protein-1)等轉錄因子發生協同作(zuò)用(yòng)。通過對(duì)NFAT的RHD/DNA二元複合物的構象研究揭示,NFAT在激活靶基因表達時(shí),是需要和(hé)AP-1家族蛋白(bái)等轉錄因子發生協同作(zuò)用(yòng)的。
NFAT蛋白(bái)C端的結構同源性較低(dī),長度變化也(yě)較大(dà)。除了(le)NFAT的N端以外(wài),在其C端也(yě)存在一段非保守序列,被稱之爲轉錄激活區(qū)(tanscriptional activation domain,TAD),也(yě)能(néng)有效執行轉錄激活功能(néng)。
NFAT參與的信号調節機制
NFAT家族中,NFAT5是目前唯一已知(zhī)的高(gāo)滲透壓激活的哺乳動物轉錄因子,NFATI-NFAT4均受細胞内鈣離子信号的調控。在靜息細胞的細胞質中,由于激酶(如CK1和(hé)DYRK2)的作(zuò)用(yòng),NFAT處于高(gāo)度磷酸化狀态。當激素、神經遞質等第一信使與細胞膜上(shàng)的受體結合,激活膜上(shàng)的G蛋白(bái),從(cóng)而激活磷酸脂酶C(phospholipase C,PLC),将膜上(shàng)的脂酰肌醇 4,5-二磷酸(phosphatidylinositolbiphosphate,PIP2)分解爲兩個細胞内的第二信使:二酰甘油(diacylglycerol,DAG)和(hé)1,4,5-三磷酸肌醇(IP3)。IP3 動員細胞内鈣庫釋放(fàng)Ca到(dào)細胞質中,激活CN(目前已知(zhī)的、唯一可以調節NFAT入核的磷酸酶),随後參與一系列的反應,比如calcineurin/NFAT 信号通路被激活;而DAG在Ca2+的協同下(xià)激活蛋白(bái)激酶C(protein kinase C,PKC),然後通過PKC引起級聯反應,進行細胞的應答(dá)。
調節NFAT核轉位的激酶主要分爲兩類,一類是輸出型激酶,即負責細胞核内NFAT的磷酸化并誘導其重新定位于細胞質,主要作(zuò)用(yòng)于SP2和(hé)SP3,如GSK3和(hé)DYRK1等;另一類維持型激酶存在細胞質中,維持細胞質中的NFAT高(gāo)度磷酸化水(shuǐ)平并抑制靜息狀态下(xià)NFAT脫磷酸向細胞核轉移,主要作(zuò)用(yòng)于SPRl和(hé)SP3,如CK1和(hé)DYRK2。NFAT的磷酸化是以一種連續磷酸化的方式進行,DYRK能(néng)夠直接磷酸化NFAT1上(shàng)保守的SP3基序,随後GSK3和(hé)CK1才能(néng)繼續磷酸化SP2和(hé)SRR1基序;而NFAT2連續磷酸化的先導激酶是cAMP 依賴蛋白(bái)激酶(protein kinase A,PKA)和(hé)DYRK,随後是GSK3,進而導緻NFAT蛋白(bái)完全磷酸化并轉移出核。
近年的研究也(yě)發現(xiàn)了(le)參與NFAT通路調節的新蛋白(bái)及其可能(néng)的機制:細胞質支架蛋白(bái) Homer2和(hé)Homer3可以和(hé)NFAT競争性結合CN,從(cóng)而阻止NFAT的脫磷酸及活化;類似于泛素的蛋白(bái)質小(xiǎo)泛素樣修飾蛋白(bái)可經由類似泛素化的過程與目标蛋白(bái)質上(shàng)特定的賴氨酸支鏈形成共價鍵,修飾目标蛋白(bái)質,而這(zhè)個過程同樣可能(néng)參與NFAT功能(néng)的調控。此外(wài),NFAT在脊椎動物發育中有一定的作(zuò)用(yòng)。在神經系統中,NFAT的活化與神經元的凋亡與損傷也(yě)存在着密切的聯系。
以NFAT蛋白(bái)爲靶點的臨床藥物的開(kāi)發前景
锂治療是目前治療神經躁郁症的主要方法。研究發現(xiàn),長期注射锂的小(xiǎo)鼠腦(nǎo)部GSK-3活性被抑制,神經元細胞發生NFAT3/4的核轉位,從(cóng)而誘導死亡配體(Fas Ligand,FasL)表達水(shuǐ)平的上(shàng)升,激活FasL/Fas凋亡通路,下(xià)遊凋亡蛋白(bái)酶caspase-3表達增加,從(cóng)而誘導随後的神經元凋亡。基于當前環孢菌素A(Cyclosporin A)等藥物在神經系統應用(yòng)的局限性,例如,在體外(wài)培養的皮層神經元中,腦(nǎo)源性神經營養因子BDNF可以刺激NFAT依賴的轉錄,而使用(yòng)CsA和(hé)FK506可以阻斷該過程;傳入神經阻滞可以激活前腹側的耳蝸神經元(anteroventral cochlearnucleus,AVCN)中的NFAT3,使其從(cóng)細胞質移位到(dào)細胞核,誘發神經元凋亡,FK506及VIVIT可以明(míng)顯抑制NFAT3的入核,減少神經元凋亡。針對(duì)NFAT以及NFAT調節信号的深入研究,将爲篩選或者開(kāi)發更爲高(gāo)效、低(dī)毒藥物提供新的思路。

 聯系我們
聯系我們





