駝類動物體内含有3種不同亞型的抗體,分别是常規抗體IgG1、天然缺失輕鏈及CH1恒定域的重鏈抗體(heavy-chain antibody,HCAb)IgG2和(hé)IgG3。這(zhè)種保留了(le)全部抗原結合能(néng)力的天然無輕鏈及CH1區(qū)的單域抗體因其質量小(xiǎo)(約15 kDa,爲IgG的十分之一),也(yě)被稱爲納米抗體(nanobodies,Nbs)或VHH抗體(variable domain of the heavy chain of heavy-chain antibody)。與傳統抗體片段如抗原結合片段(fragment of antigen binding,Fab)和(hé)單鏈抗體(single chain antibody fragment,scFv)相比,納米抗體(nanobodies,Nbs)具有多個明(míng)顯的優勢,比如免疫原性弱、生産成本低(dī)、水(shuǐ)溶性好(hǎo)、組織滲透性好(hǎo)、穩定性與親和(hé)力較高(gāo)等。正是這(zhè)些(xiē)優良特性使得納米抗體(nanobodies,Nbs)在生物技術方面得到(dào)了(le)非常廣泛的應用(yòng)。
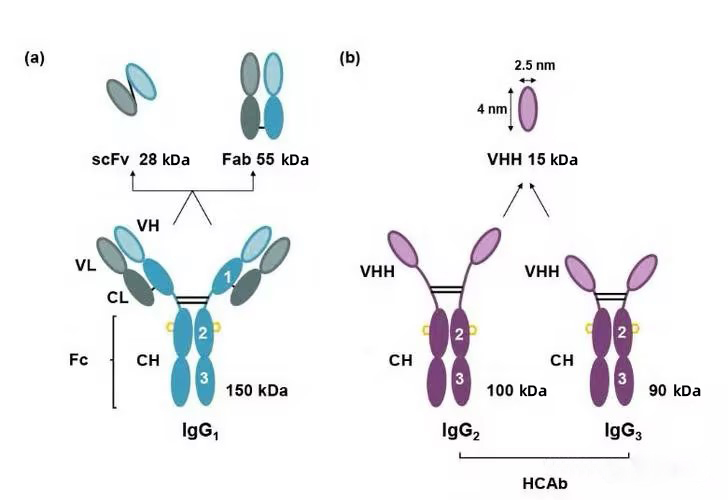
Structures and molecular mass of three different subtypes of antibodies and antibody fragments in camelid animals
對(duì)于大(dà)多數應用(yòng)而言,穩定性是制約抗體應用(yòng)的關鍵因素之一。一方面抗體在其生産、運輸、儲存及使用(yòng)的過程中容易發生多種物理(lǐ)和(hé)化學降解,另一方面抗體的不穩定性聚集會(huì)潛在地影響産量、保質期和(hé)免疫原性等應用(yòng)參數。因此抗體的穩定性不僅會(huì)影響其生物學和(hé)生化評估,還會(huì)影響純化、儲存以及配方設計(jì)和(hé)生産。在各種類型的抗體中,納米抗體(nanobodies,Nbs)顯示出極好(hǎo)的溶解性,并且對(duì)高(gāo)溫和(hé)化學變性具有顯著的抗性,可以很(hěn)大(dà)程度地克服傳統抗體片段scFv的聚集和(hé)降解等穩定性問題,是許多應用(yòng)的理(lǐ)想選擇。
納米抗體(nanobodies,Nbs)與常規抗體可變區(qū)(variable region of heavy chain,VH)的空(kōng)間結構相似,其框架是由9個反向平行的β折疊片層(A-B-C-D-E-F-G-H-I)通過鏈間氫鍵和(hé)二硫鍵連接在一起組成。在此結構中,3個CDR分别連接BC、DE和(hé)HI鏈,并靠N端形成連續表面,與抗原表位的表面互補。連接CDR之間的氨基酸序列相對(duì)比較保守,稱爲骨架區(qū)(framework region,FR)。幾乎所有納米抗體(nanobodies,Nbs)結構都含有一個連接FR1(C23)和(hé)FR3(C104)的保守二硫鍵,該鍵跨越蛋白(bái)質的内部,将兩個β鏈連接起來(lái),增加了(le)結構穩定性。部分納米抗體(nanobodies,Nbs)還含有一個可限制CDR環柔韌性和(hé)構象自(zì)由度的額外(wài)二硫鍵。
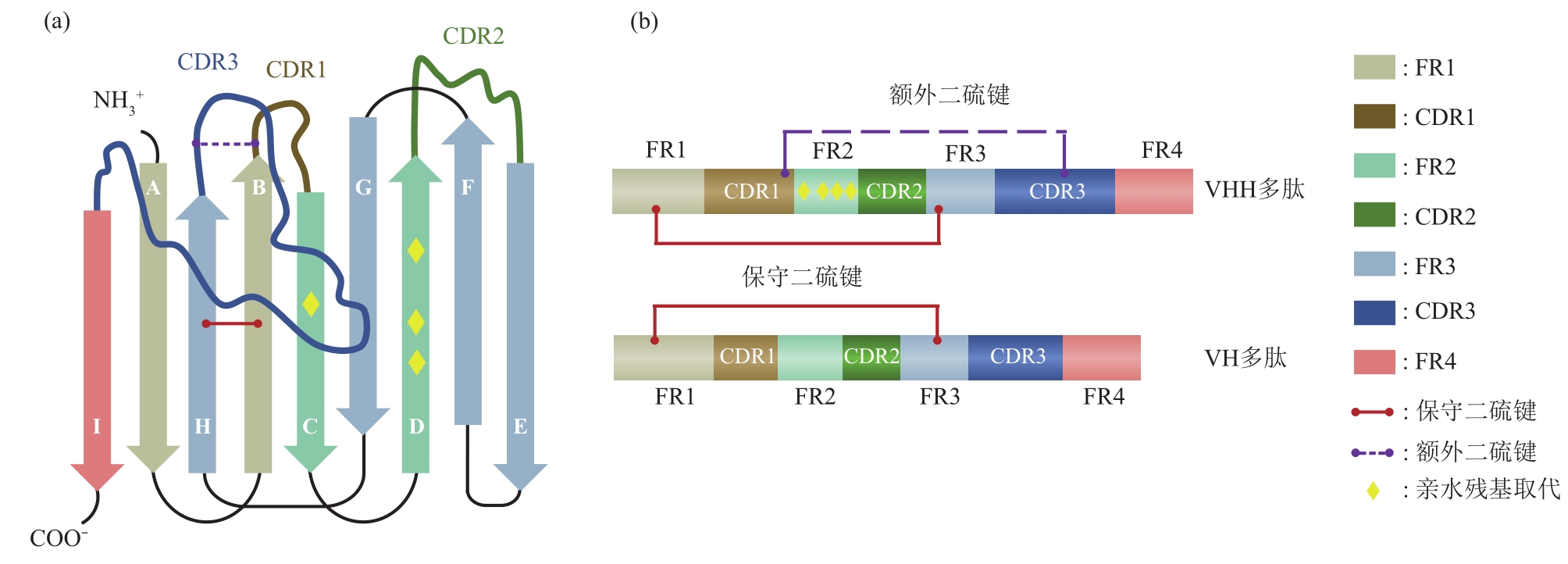 Structure of Nbs
Structure of Nbs
傳統抗體VH和(hé)VL通過疏水(shuǐ)作(zuò)用(yòng)力來(lái)穩定結構并共同構成抗原結合區(qū)。與之相比,納米抗體(nanobodies,Nbs)僅含有3個可變區(qū),盡管與抗原結合界面的表面積減少,但(dàn)其仍具有較高(gāo)的穩定性與親和(hé)力。
它主要通過以下(xià)兩種方式來(lái)适應輕鏈的缺失:
一、大(dà)量的親水(shuǐ)性氨基酸取代先前與CH1、VL結合界面的脂肪族殘基(L12S、V42F/Y、G49E、L50R/C、W52G/L),且部分FR2被拉伸扭轉的CDR3環覆蓋,避免與外(wài)界水(shuǐ)環境的接觸,從(cóng)而防止納米抗體(nanobodies,Nbs)的二聚化,其CDR3環越長,納米抗體(nanobodies,Nbs)越穩定。另外(wài)還可在CDR3末端形成疏水(shuǐ)核心,有利于穩定Nbs的折疊結構域。
二、納米抗體(nanobodies,Nbs)的CDR1和(hé)CDR3普遍比VH的長,潛在地增加了(le)互補位構象的多樣性,從(cóng)而以高(gāo)度的形狀表面互補性與相應的抗原結合,一定程度上(shàng)彌補了(le)輕鏈缺失造成的抗原結合力下(xià)降以及因尺寸小(xiǎo)而導緻的潛在序列多樣性降低(dī)。
納米抗體(nanobodies,Nbs)的小(xiǎo)分子和(hé)單域屬性賦予了(le)其比常規抗體更爲穩定的特性,然而并非所有的納米抗體(nanobodies,Nbs)都具有很(hěn)好(hǎo)的熱穩定性與化學穩定性。在以往研究的多個納米抗體(nanobodies,Nbs)中,大(dà)約有2/3的納米抗體(nanobodies,Nbs)在65℃處理(lǐ)後發生了(le)不可逆的聚集,但(dàn)是部分納米抗體(nanobodies,Nbs)在90℃高(gāo)溫處理(lǐ)後仍具有90%的活性。這(zhè)些(xiē)穩定性差異的根本原因在于納米抗體(nanobodies,Nbs)特殊結構的差異,包括氨基酸序列、二硫鍵的數量與位置、結構域的構象等。
那麽,如何構建穩定性更高(gāo)、親和(hé)力更強的納米抗體(nanobodies,Nbs)呢(ne)?普健生物深耕蛋白(bái)抗體領域15餘年,在高(gāo)質量納米抗體(nanobodies,Nbs)制備技術上(shàng)擁有自(zì)主核心技術,與知(zhī)名科研單位、研究院所、醫(yī)藥研發企業成功合作(zuò)相關項目20000+。在納米抗體的制備方面,動物的選擇是免疫成功的關鍵,普健生物自(zì)建養殖基地,每年近百頭成年羊駝用(yòng)于免疫,穩定提供大(dà)量的免疫抗原。通過設計(jì)目标抗原對(duì)健康強壯、精神良好(hǎo)、體型适中的羊駝進行四輪免疫後進行效價檢測,當血清免疫效價達到(dào)預期後,再提取總RNA用(yòng)于噬菌體文(wén)庫的構建,利用(yòng)噬菌體展示技術進行篩選得到(dào)高(gāo)特異性和(hé)強親和(hé)力的納米抗體。
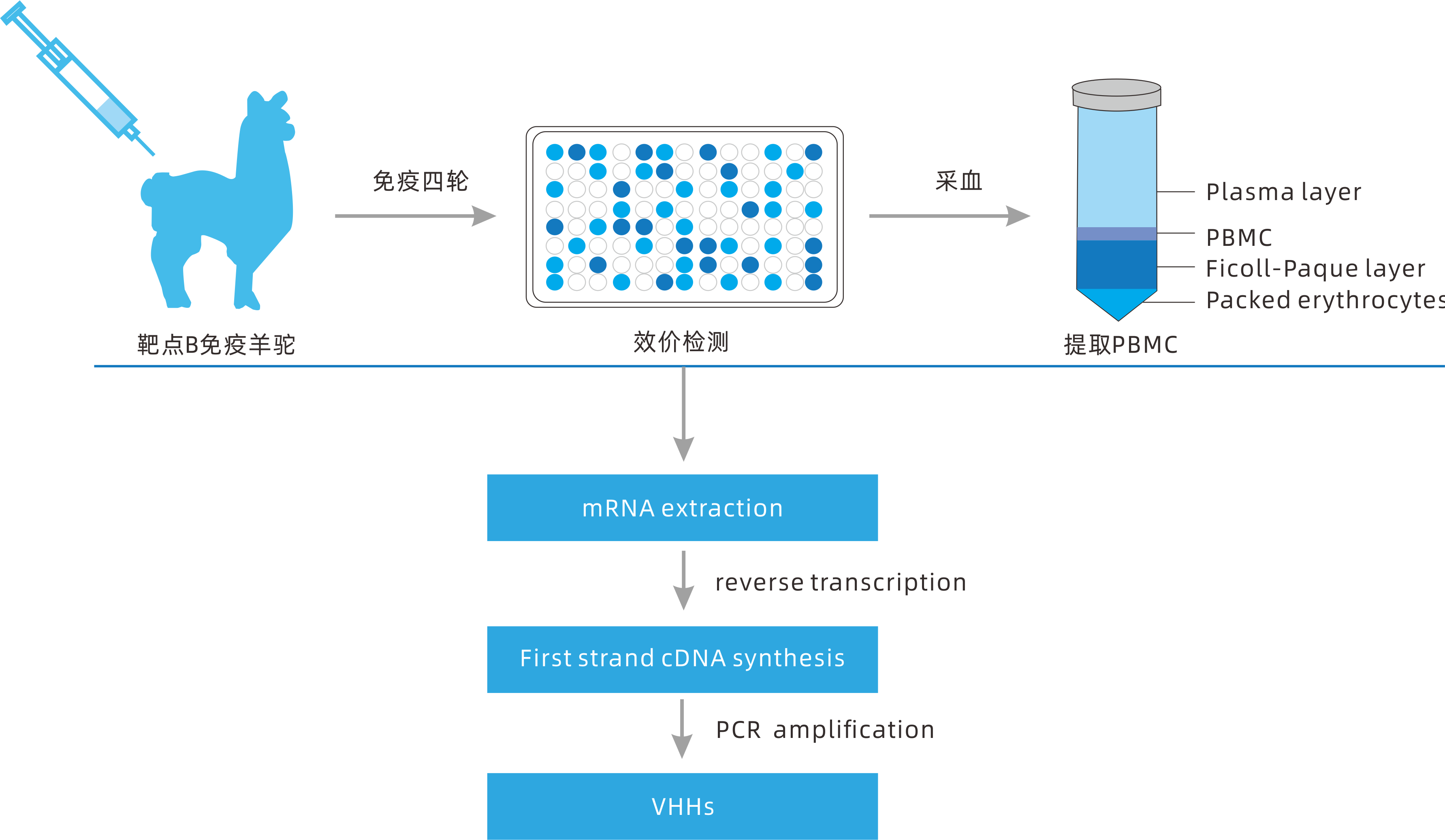
此外(wài),普健生物還可根據科研需求,在分子設計(jì)時(shí)選擇性加入功能(néng)區(qū)或基于納米抗體(nanobodies,Nbs)結構特征采用(yòng)合理(lǐ)的設計(jì)方法進行結構穩定性優化,例如共有序列驅動的序列修複、替換易于修飾的氨基酸、非天然二硫鍵的引入和(hé)CDR的移植。通過這(zhè)些(xiē)策略開(kāi)發出在極端條件下(xià)仍能(néng)保持結合能(néng)力的穩定Nbs,從(cóng)而爲生物技術、檢測、診斷和(hé)治療應用(yòng)提供高(gāo)性能(néng)的試劑。
選擇普健生物納米抗體(nanobodies,Nbs)的優勢
普健生物可以提供針對(duì)特定靶點的特異性納米抗體定制服務,包括抗原檢測,羊駝免疫,采血,效價檢測,納米抗體噬菌體庫構建及淘選,特異性高(gāo)親和(hé)力納米抗體篩選,表達,檢測一條龍服務。親和(hé)力可以達到(dào)108~1010M級别。
自(zì)建養殖基地:每年近百頭成年羊駝用(yòng)于免疫,穩定提供大(dà)量的免疫抗原
庫容大(dà):近千億級别天然庫
淘選周期短:最快(kuài)在2周内可完成針對(duì)各類靶點的特異性納米抗體快(kuài)速篩選
親和(hé)力高(gāo):抗體親和(hé)力可達10-9M 級别
樣本來(lái)源豐富:免疫庫源自(zì)百餘隻不同種類的駝類樣本-羊駝(Alpaca )、駱駝(Camel)、美(měi)洲駝(Llama),提供更高(gāo)抗體多樣性
超高(gāo)品質:插入正确率100%,序列正确率97%,随機選取200個克隆測序,均無重複序列
可構建免疫庫,獲得更高(gāo)親和(hé)力VHH序列
參考文(wén)獻
[1]Hamers-Casterman C, Atarhouch T, Muyldermans S, et al. Naturally occurring antibodies devoid of light chains. Nature, 1993, 363(6428): 446-448
[2]Li C, Tang Z, Hu Z, et al. Natural single-domain antibody-nanobody: a novel concept in the antibody field. J Biomed Nanotechnol, 2018, 14(1): 1-19
[3]Steeland S, Vandenbroucke R E, Libert C. Nanobodies as therapeutics: big opportunities for small antibodies. Drug Discov Today, 2016, 21(7): 1076-1113
[4]He T, Zhu J, Nie Y, et al. Nanobody technology for mycotoxin detection in the field of food safety: current status and prospects. Toxins, 2018, 10(5): 180
[5]Hoey R J, Eom H, Horn J R. Structure and development of single domain antibodies as modules for therapeutics and diagnostics. Exp Biol Med, 2019, 244(17): 1568-1576
[6]Liu M, Li L, Jin D, et al. Nanobody–a versatile tool for cancer diagnosis and therapeutics. Wiley Interdiscip Rev Nanomed Nanobiotechnol, 2021, 13(4): e1697
[7]Kunz P, Zinner K, Mücke N, et al. The structural basis of nanobody unfolding reversibility and thermoresistance. Sci Rep, 2018, 8(1): 7934
[8]Akazawa-Ogawa Y, Takashima M, Lee Y H, et al. Heat-induced irreversible denaturation of the camelid single domain VHH antibody is governed by chemical modifications. J Biol Chem, 2014, 289(22): 15666-15679
[9]Hagihara Y, Mine S, Uegaki K. Stabilization of an immunoglobulin fold domain by an engineered disulfide bond at the buried hydrophobic region. J Biol Chem, 2007, 282(50): 36489-36495
[10]Turner K B, Liu J L, Zabetakis D, et al. Improving the biophysical properties of anti-ricin single-domain antibodies. Biotechnol Rep, 2015, 6: 27-35
[11]Zabetakis D, Olson M A, Anderson G P, et al. Evaluation of disulfide bond position to enhance the thermal stability of a highly stable single domain antibody. PLoS One, 2014, 9(12): e115405
[12]Melarkode V A, Shinada N K, Narwani T J, et al. Discrete analysis of camelid variable domains: sequences, structures, and in-silico structure prediction. PeerJ, 2020, 8: e8408
[13]Lefranc M P, Lefranc G. IMGT® and 30 years of immunoinformatics insight in antibody V and C domain structure and function. Antibodies, 2019, 8(2): 29
[14]Govaert J, Pellis M, Deschacht N, et al. Dual beneficial effect of interloop disulfide bond for single domain antibody fragments. J Biol Chem, 2012, 287(3): 1970-1979
[15]Vincke C, Muyldermans S. Introduction to heavy chain antibodies and derived nanobodies. Methods Mol Biol, 2012, 911: 15-26
[16]Kunz P, Ortale A, Mücke N, et al. Nanobody stability engineering by employing the Delta ΔTm shift; a comparison with apparent rate constants of heat-induced aggregation. Protein Eng Des Sel, 2019, 32(5): 241-249
[17]Mendoza M N, Jian M, King M T, et al. Role of a noncanonical disulfide bond in the stability, affinity, and flexibility of a VHH specific for the Listeria virulence factor InlB. Protein Sci, 2020, 29(4): 1004-1017

 聯系我們
聯系我們





