阿爾茨海默病(Alzheimer’s disease,AD)俗稱老(lǎo)年癡呆症,是一種典型的神經退行性疾病,主要病理(lǐ)特征是腦(nǎo)萎縮和(hé)腦(nǎo)細胞死亡。該病自(zì)1906年被首次報(bào)道(dào)以來(lái)已有百年之久,目前仍未完全明(míng)确其發病機制,針對(duì)各種發病機制假說(如β澱粉樣蛋白(bái)級聯學說、Tau蛋白(bái)異常磷酸化學說、膽堿能(néng)學說、神經炎症等)的藥物研發目前也(yě)僅有Aducanumab、Lecanemab被美(měi)國FDA批準上(shàng)市。Aducanumab、Lecanemab是通過清除AD患者大(dà)腦(nǎo)内β澱粉樣斑塊而發揮作(zuò)用(yòng)的單克隆抗體藥物。研究表明(míng),人體内轉甲狀腺素蛋白(bái)(transthyretin,TTR)對(duì)AD具有神經保護作(zuò)用(yòng),這(zhè)種神經保護作(zuò)用(yòng)能(néng)夠延緩AD的疾病進程。
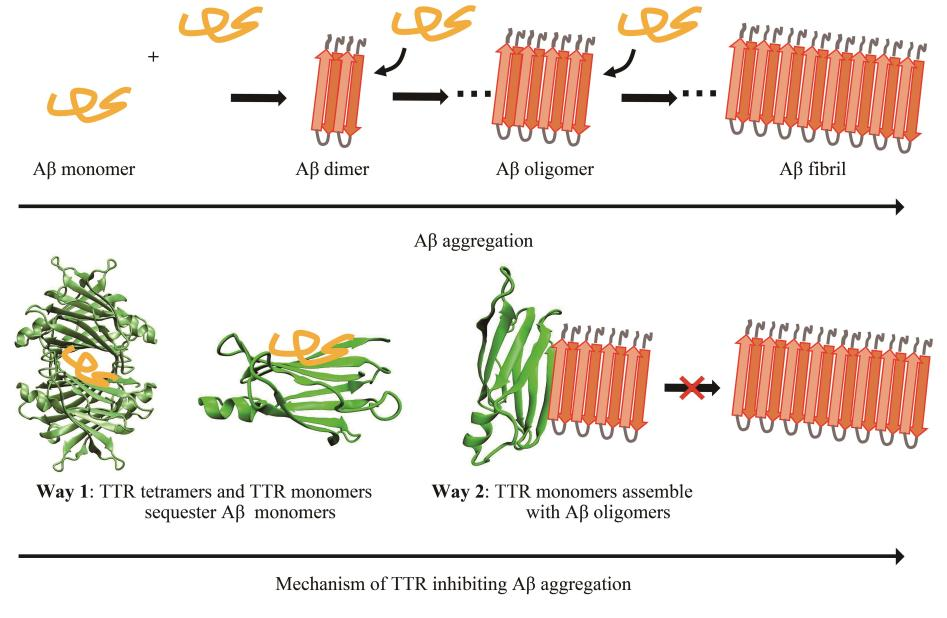
轉甲狀腺素蛋白(bái)(transthyretin,TTR)負責甲狀腺素和(hé)視(shì)黃醇在人體内的轉運工(gōng)作(zuò)。正常情況下(xià),TTR是一種同源四聚體蛋白(bái),其四聚體結構非常穩定。但(dàn)當TTR四聚體解離成單體後,TTR單體會(huì)迅速發生錯誤折疊并聚集形成澱粉樣纖維,最終導緻TTR澱粉樣變性,如澱粉樣心肌症。盡管TTR的錯誤折疊與TTR澱粉樣變性密切相關,但(dàn)多項證據表明(míng),TTR對(duì)AD具有神經保護作(zuò)用(yòng)。那麽,TTR與Aβ二者作(zuò)用(yòng)的詳細機制如何?是否可爲TTR神經保護作(zuò)用(yòng)機制的抗AD藥物設計(jì)提供理(lǐ)論依據?
The initial structures for protein-protein docking
針對(duì)轉甲狀腺素蛋白(bái)(transthyretin,TTR)和(hé)Aβ蛋白(bái)的研究,首先需要高(gāo)質量的蛋白(bái)滿足研究需求。武漢佰樂博生物(Biolab Reagents)作(zuò)爲普健生物旗下(xià)控股子品牌,專注于引進、整合全球業内高(gāo)品質蛋白(bái)、抗體産品。作(zuò)爲法國ProteoGenix、Antibodysystem品牌亞洲區(qū)獨家運營代理(lǐ)商。提供近2萬種以蛋白(bái)、抗體爲核心的生命科學試劑,旨在爲生命科學科研工(gōng)作(zuò)者提供專業、全面、可靠的試劑産品。這(zhè)項研究中,佰樂博不但(dàn)可提供研究所需的針對(duì)轉甲狀腺素蛋白(bái)(transthyretin,TTR)和(hé)Aβ蛋白(bái),還可提供更多AD疾病相關的蛋白(bái)抗體試劑。

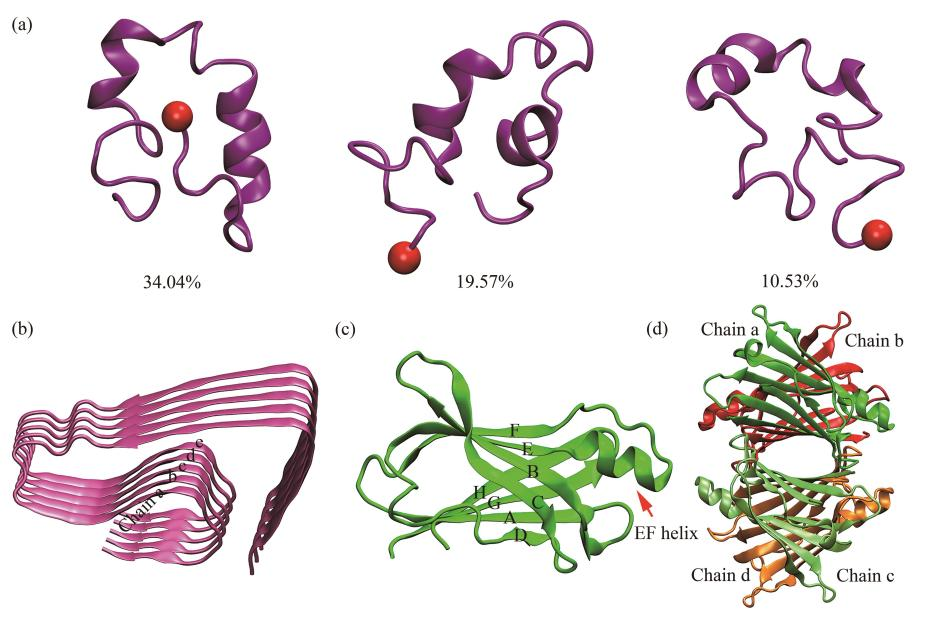
常見的Aβ形式有Aβ1-40及Aβ1-42,但(dàn)Aβ1-42在體内的聚集傾向及細胞毒性更強,通常使用(yòng)Aβ1-42來(lái)作(zuò)爲研究對(duì)象。該結構是一個通過冷凍電鏡技術輔以固體NMR實驗獲得的近原子分辨率的纖維聚集體結構,結構中所有42個殘基的骨架和(hé)幾乎所有的側鏈在冷凍電鏡密度圖中都得到(dào)很(hěn)好(hǎo)的解析。研究表明(míng),較小(xiǎo)的可溶性Aβ低(dī)聚體是Aβ細胞毒性的主要形式,因此在研究轉甲狀腺素蛋白(bái)(transthyretin,TTR)與Aβ蛋白(bái)機制時(shí),以五聚體作(zuò)爲Aβ低(dī)聚體的代表形态更具代表性。
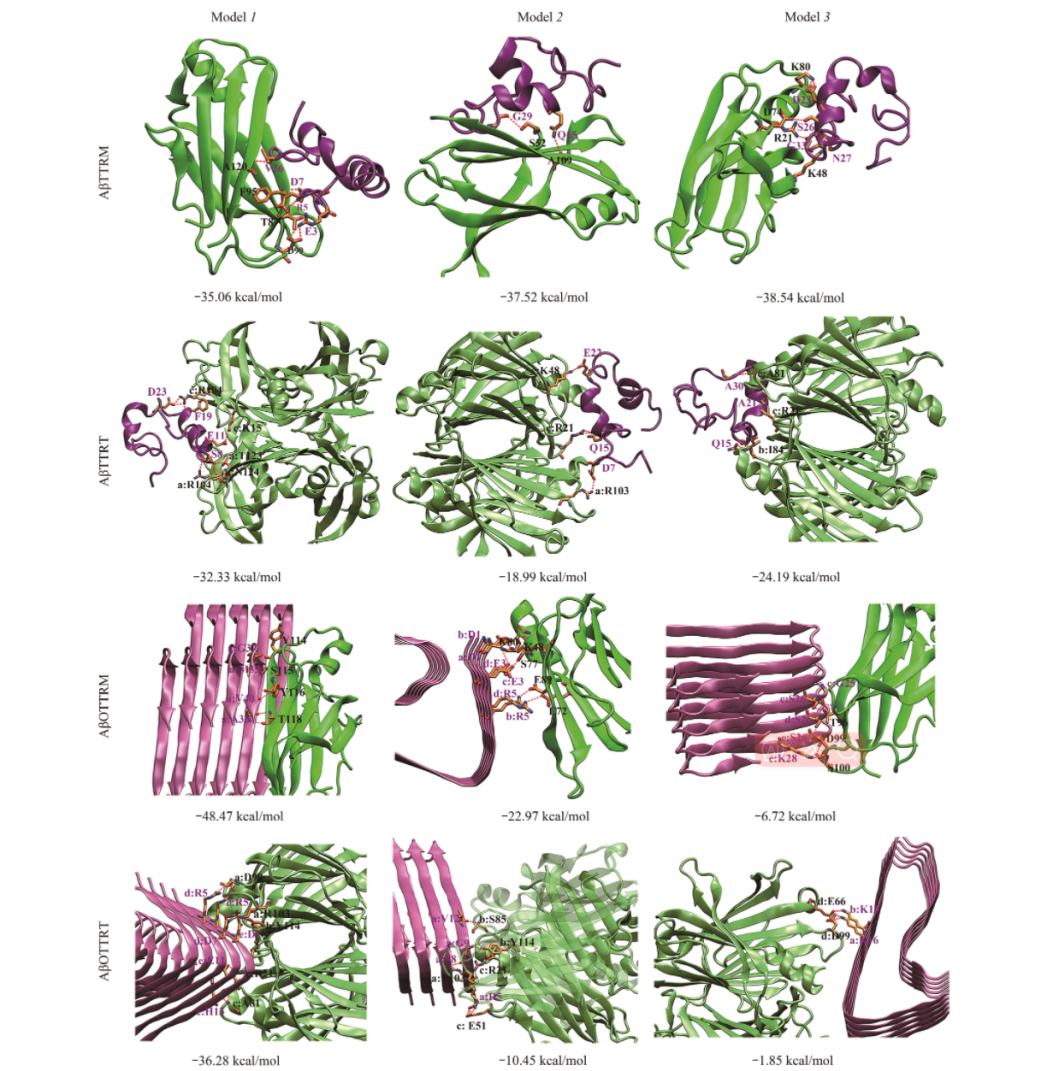
爲了(le)獲得用(yòng)于描述TTR/Aβ相互作(zuò)用(yòng)的複合物結構,進行蛋白(bái)質-蛋白(bái)質的分子對(duì)接。爲探究TTR及Aβ不同結構形态對(duì)二者相互作(zuò)用(yòng)的影響,分别對(duì)TTR單體/Aβ單體、TTR四聚體/Aβ單體、TTR單體/Aβ五聚體及TTR四聚體/Aβ五聚體進行了(le)分子對(duì)接,各體系分别标記爲AβTTRM、AβTTRT、AβOTTRM和(hé)AβOTTRT。爲了(le)深入探究TTR與Aβ的相互作(zuò)用(yòng)過程,進一步對(duì)各體系進行了(le)分子動力學模拟。
The protein-protein docking models for each system
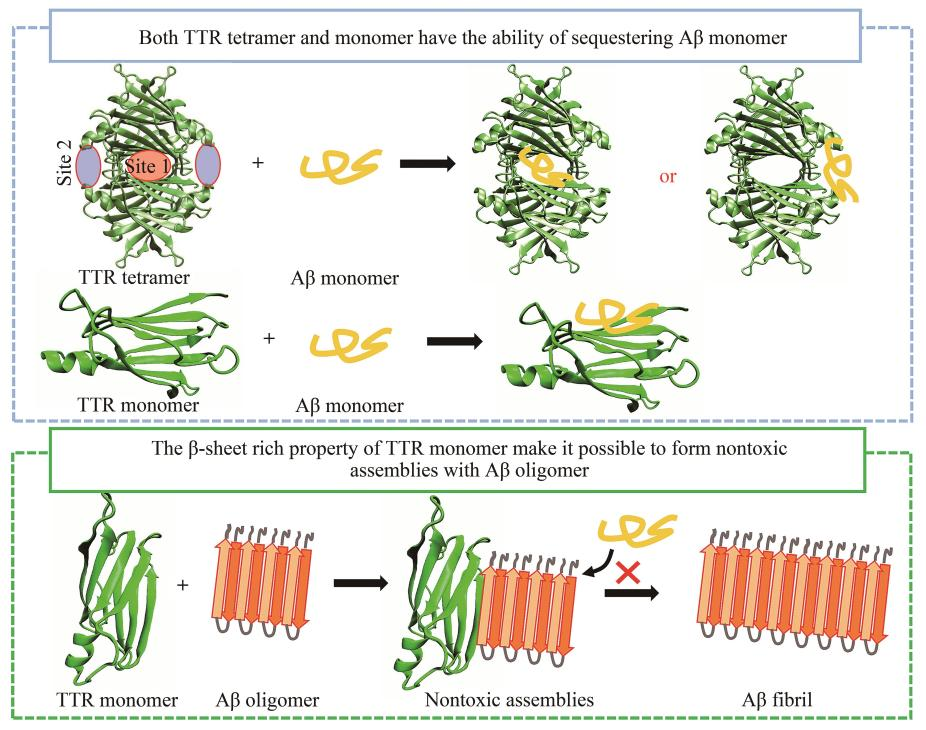
結果表明(míng),TTR四聚體及單體均能(néng)與Aβ單體作(zuò)用(yòng),TTR四聚體的甲狀腺素結合通道(dào)是Aβ單體的主要結合部位。此外(wài),TTR四聚體的EF螺旋、EF loop同樣能(néng)夠結合Aβ單體。當TTR四聚體解離後,TTR單體的内部片層疏水(shuǐ)部位暴露,該部位對(duì)Aβ單體具有較強的親和(hé)力。TTR與Aβ聚集體作(zuò)用(yòng),由于TTR單體與Aβ聚集體均爲富含β折疊的結構,使得二者能(néng)夠共聚集形成聚合度更高(gāo)的聚集體,從(cóng)而降低(dī)Aβ聚集體的細胞毒性。
The illustration of speculative interaction mechanisms between TTR and Aβ
這(zhè)項研究表明(míng),TTR結構的特殊性使得其對(duì)Aβ單體具有較強的相互作(zuò)用(yòng)能(néng)力,可通過“扣押”單體的形式抑制Aβ的聚集。這(zhè)種結構特殊性表現(xiàn)爲:a. 正常情況下(xià)TTR以穩定四聚體形式存在,其結構中的T4結合通道(dào)及視(shì)黃醇結合部位爲Aβ提供了(le)适當的結合空(kōng)間,有利于Aβ單體的結合;b. 四聚體解離産生TTR單體,導緻疏水(shuǐ)界面DAGH折疊片層的暴露,使得Aβ單體同樣能(néng)夠作(zuò)用(yòng)于該疏水(shuǐ)界面(Aβ單體的疏水(shuǐ)核心爲17LVFFA21),達到(dào)“扣押”Aβ單體的作(zuò)用(yòng)。其次,TTR單體的結構特征與Aβ聚集體的結構相似,均爲富含β折疊的結構,這(zhè)使得TTR單體能(néng)夠與Aβ聚集體共聚形成聚合度更高(gāo)的無毒聚集體,從(cóng)而達到(dào)抑制Aβ細胞毒性的效果。整體而言,本工(gōng)作(zuò)在原子尺度上(shàng)探究了(le)TTR與Aβ相互作(zuò)用(yòng)的機制,并揭示了(le)TTR神經保護作(zuò)用(yòng)的分子機制,在一定程度上(shàng)爲基于TTR神經保護作(zuò)用(yòng)機制的抗AD藥物研發提供了(le)理(lǐ)論線索。
參考文(wén)獻
- ZHOU Shuang-Yan,HUANG Yao-Xin,LI Xin,et al.Molecular Mechanism Study of β-amyloid Aggregation Inhibition by Transthyretin[J].Progress in Biochemistry and Biophysics,2024,51(03):633-646.
- Xu H, Zhao Y, Qi Y, et al. Therapeutic nanosweepers promote β‑amyloid removal from the brain for Alzheimer’s disease treatment. Biomater Sci, 2022, 10(22): 6525-6534
- Guo X, Lie Q, Liu Y, et al. Multifunctional selenium quantum dots for the treatment of Alzheimer’s disease by reducing Aβ‑neurotoxicity and oxidative stress and alleviate neuroinflammation. ACS Appl Mater Interfaces, 2021, 13(26): 30261-30273
- Ueda M, Transthyretin: its function and amyloid formation. Neurochem Int, 2022, 155: 105313
- Cao Q, Anderson D H, Liang W Y, et al. The inhibition of cellular toxicity of amyloid‑β by dissociated transthyretin. J Biol Chem, 2020, 295(41): 14015-14024
- Cotrina E Y, Santos L M, Rivas J, et al. Targeting transthyretin in Alzheimer’s disease: drug discovery of small-molecule chaperones as disease-modifying drug candidates for Alzheimer’s disease. Eur J Med Chem, 2021, 226: 113847

 聯系我們
聯系我們





