抗體偶聯藥物(antibody drug conjugate,ADC)通常由抗體通過鏈接體與毒素小(xiǎo)分子偶聯而成,因其同時(shí)具備抗體的高(gāo)靶向性和(hé)小(xiǎo)分子藥物的高(gāo)活性,在腫瘤治療領域展現(xiàn)出了(le)優秀的療效和(hé)潛力,成爲藥物研發領域的新熱點。目前全球已有14款ADC藥物獲批上(shàng)市,處于臨床研究階段的ADC候選藥物分子超過140個。
抗體偶聯藥物(antibody drug conjugate,ADC)作(zuò)爲一類新興的大(dà)分子靶向藥物,目前主要用(yòng)于各種腫瘤。ADC藥物由靶向腫瘤細胞過度表達的表面受體的抗體、高(gāo)活性的細胞毒素小(xiǎo)分子和(hé)鏈接體3個部分組成。其中,抗體部分負責将ADC藥物分子精準運送至靶細胞表面,鏈接體負責在靶細胞内或表面釋放(fàng)毒素小(xiǎo)分子,而高(gāo)活性的細胞毒素小(xiǎo)分子則高(gāo)效地殺傷腫瘤細胞,因此ADC也(yě)被通俗地稱爲“生物導彈”或者“魔法子彈”。
魔法子彈這(zhè)一概念是由諾貝爾獎獲得者德國科學家Paul Ehrlich在20世紀初提出的,特指一類能(néng)靶向結合目标病竈進而治愈疾病的一類分子。1957年,Mathé等将化療藥物甲氨蝶呤通過重氮偶合反應偶聯至抗L1210白(bái)血病細胞的免疫球蛋白(bái)上(shàng)實現(xiàn)對(duì)靶細胞L1210抑制細胞增殖,從(cóng)而将這(zhè)一概念實物化爲抗體加上(shàng)毒素小(xiǎo)分子這(zhè)一藥物分子形式。1970年代中期,有多個利用(yòng)動物源免疫球蛋白(bái)制備的ADC在臨床試驗中展現(xiàn)出了(le)确定的療效。1980年代,單克隆抗體開(kāi)發技術和(hé)重組蛋白(bái)生産技術的進步、多種腫瘤标志物的确證以及對(duì)靶點抗原-抗體介導的細胞内吞機制的闡明(míng),同時(shí)在靶點、抗體以及鏈接體等多個方面給ADC藥物的技術發展帶來(lái)了(le)巨大(dà)推動力,進而在1990年代吸引了(le)藥物研發和(hé)生物科技公司加大(dà)投入ADC藥物的開(kāi)發,并于2000年迎來(lái)第一個ADC藥物Mylotarg®的獲批上(shàng)市。Mylotarg®是CD33靶向的ADC用(yòng)于治療急性髓系白(bái)血病(acute myeloid leukemia,AML)。随後,用(yòng)于治療霍奇金(jīn)淋巴瘤(Hodgkin lymphoma,HL)和(hé)間變性大(dà)細胞淋巴瘤(anaplastic large cell lymphoma,ALCL)的CD30靶向的Adcetris®在2011年獲批上(shàng)市,用(yòng)于治療晚期轉移性乳腺癌的HER2靶向的Kadcyla®于2013年獲批上(shàng)市。這(zhè)兩款ADC藥物在晚期腫瘤患者中的顯著療效和(hé)良好(hǎo)的安全性,使得ADC藥物正式作(zuò)爲一類新型的治療手段得到(dào)腫瘤患者、腫瘤醫(yī)療界和(hé)生物制藥工(gōng)業界的廣泛認可,迅速成爲了(le)全球生物醫(yī)藥學術界以及工(gōng)業界的熱點領域之一。截至2023年3月全球已有14款ADC藥物獲批上(shàng)市,其中9款是在近5年内獲批的,處于臨床研究階段的ADC藥物分子則超過140個,而且呈現(xiàn)逐年快(kuài)速增長的趨勢,有望給腫瘤患者帶來(lái)更有效的治療藥物。
|
商品名 |
藥品通用(yòng)名 |
靶标 |
适應症 |
抗體 |
鏈接體 |
毒素 |
開(kāi)發者 |
批準時(shí)間 |
|
Mylotarg® |
Gemtuzumab ozogamicin |
CD33 |
AML |
人源化IgG4 |
腙 |
卡利黴素 |
輝瑞(惠氏) |
2000年FDA
|
|
Adcetris® |
Brentuximab vedotin |
CD30 |
HL、sALCL |
人鼠嵌合IgG1 |
缬氨酸-瓜氨酸 |
MMAE |
西雅圖遺傳 |
2011年 FDA;2020年NMPA |
|
Kadcyla® |
Trastuzumab ado-emtansine |
HER2 |
mBC |
人源化IgG1 |
硫醚 |
DM1 |
羅氏/基因泰克 |
2013年 FDA;2020年NMPA |
|
Besponsa® |
Inotuzumab ozogamicin |
CD22 |
ALL |
人源化IgG4 |
腙 |
卡利黴素 |
輝瑞 |
2017 年EMA&FDA;2021年NMPA |
|
Lumoxiti® |
Moxetumomab pasudotox |
CD22 |
R/R HCL |
鼠源免疫球蛋白(bái)可變區(qū) |
融合蛋白(bái) |
假單胞菌外(wài)毒素A |
阿斯利康 |
2018 年FDA |
|
Polivy® |
Polatuzumab vedotin |
CD79b |
DLBCL |
人源化IgG1 |
缬氨酸-瓜氨酸 |
MMAE |
羅氏/基因泰克 |
2019年 FDA
|
|
Padcev® |
Enfortumab vedotin |
Nectin-4 |
mUC |
人源化IgG1 |
缬氨酸-瓜氨酸 |
MMAE |
安斯泰來(lái)/西雅圖遺傳 |
2019年 FDA
|
|
Enhertu® |
Trastuzumab deruxtecan |
HER2 |
mBC |
人源化IgG1 |
四肽 |
Dxd |
第一三共/阿斯利康 |
2019年 FDA 2023年NMPA |
|
Trodelvy® |
Sacituzumab govitecan |
Trop-2 |
mTNBC |
人源化IgG1 |
碳酸酯 |
SN-38 |
Immunomedics |
2020年 FDA 2022年NMPA |
|
Blenrep® |
Belantamab mafodotin |
BCMA |
R/R MM |
人源化IgG1 |
馬來(lái)酰亞氨基己酰 |
MMAF |
葛蘭素史克 |
2020年 FDA
|
|
Zynlonta® |
loncastuximab tesirine |
CD19 |
R/R LBCL |
人源化IgG1 |
缬氨酸-丙氨酸 |
PBD二聚體 |
ADC Therapeutics |
2021年 FDA
|
|
愛地希® |
Disitamab vedotin |
HER2 |
mGC |
人源化IgG1 |
缬氨酸-瓜氨酸 |
MMAE |
榮昌生物 |
2021年NMPA |
|
Tivdak® |
Tisotumab vedotin |
TF |
mCC |
人源化IgG1 |
缬氨酸-瓜氨酸 |
MMAE |
西雅圖遺傳/Genmab |
2021年 FDA
|
|
ElahereTM |
Mirvetuximab soravtansine |
FRα |
鉑治療失敗OC |
人源化IgG1 |
sulfo-SPDB |
DM4 |
ImmunoGen |
2022年 FDA
|
AML:間變性髓系白(bái)血病(anaplastic myeloid leukemia);HL:霍奇金(jīn)淋巴瘤(Hodgkin lymphoma);sALCL:系統性間變性大(dà)細胞淋巴瘤(systemic anaplastic large cell lymphoma);mBC:轉移性乳腺癌(metastatic breast cancer);ALL:急性淋巴細胞白(bái)血病(acute lymphocytic leukemia);R/R HCL:複發/難治性毛細胞白(bái)血病(relapsed/ refractory hairy cell leukemia);DLBCL:彌漫性大(dà)B細胞淋巴瘤(diffuse large B cell lymphoma);mUC:轉移性尿路上(shàng)皮癌(metastatic urothelial cancer);mTNBC:轉移性三陰性乳腺癌(metastatic triple negative breast cancer);R/R MM:複發/難治性多發性骨髓瘤 (relapsed/refractory multiple myeloma);R/R LBCL:複發/難治性大(dà)B細胞淋巴瘤(relapsed/refractory large B cell lymphoma);mGC:轉移性胃癌(metastatic gastric cancer);mCC:轉移性宮頸癌(metastatic cervical cancer);OC:卵巢癌(ovarian cancer);PBD:pyrrolobenzodiazepine
這(zhè)些(xiē)ADC藥物的成功獲批上(shàng)市,一方面證明(míng)了(le)此類新型藥物對(duì)于腫瘤治療的顯著療效和(hé)潛力,另一方面這(zhè)些(xiē)藥物在臨床試驗和(hé)獲批上(shàng)市後大(dà)量病人使用(yòng)過程中也(yě)逐步揭示了(le)現(xiàn)有ADC藥物的局限性,例如脫靶毒性、複雜(zá)的藥代動力學特性、靶标組織富集度不足、耐藥性、實體瘤穿透力不夠等。爲了(le)進一步提高(gāo)ADC藥物的療效,降低(dī)其毒副作(zuò)用(yòng),各種新穎的技術和(hé)解決方案層出不窮。
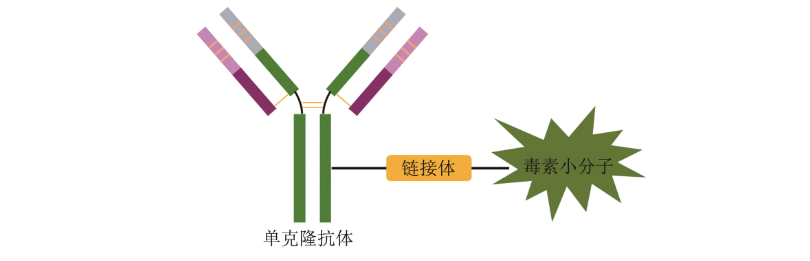
經典的ADC藥物由單克隆抗體、鏈接體和(hé)毒素小(xiǎo)分子3部分組成。每個組成部分發揮着不同的功能(néng):抗體部分負責将ADC分子選擇性地遞送至腫瘤細胞表面,同時(shí)通過靶點介導的内吞作(zuò)用(yòng)進入到(dào)細胞内;鏈接體則負責在腫瘤細胞内或者表面高(gāo)效釋放(fàng)毒素小(xiǎo)分子,而在血液循環系統中保持穩定;毒素小(xiǎo)分子則負責高(gāo)效地殺傷腫瘤細胞,有些(xiē)小(xiǎo)分子還同時(shí)具備細胞穿膜滲透性,可以通過擴散效應作(zuò)用(yòng)于靶細胞周圍的腫瘤細胞,起到(dào)“旁殺效應(bystander effect)”。因此,ADC藥物每個組成部分的特性都對(duì)其發揮靶向治療作(zuò)用(yòng)至關重要,同時(shí)各個組分的選擇也(yě)都可能(néng)會(huì)影響到(dào)ADC的安全性和(hé)有效性。
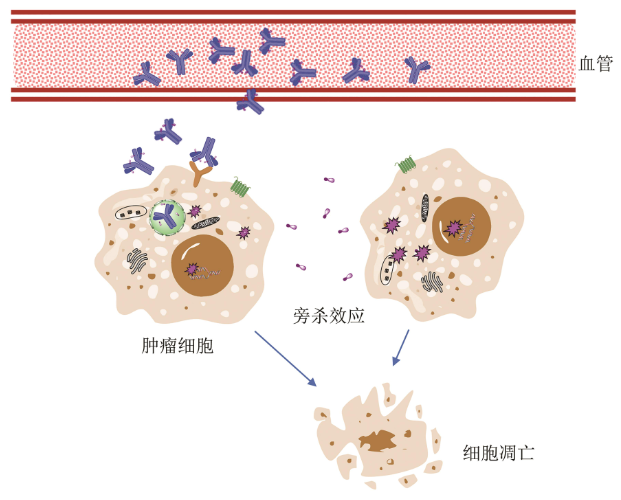
ADC殺傷腫瘤細胞的作(zuò)用(yòng)機制
作(zuò)爲ADC藥物的主體框架結構和(hé)導航系統,理(lǐ)想的抗體組分需具備較低(dī)的免疫原性、特異性的靶點結合和(hé)高(gāo)親和(hé)力、較長的半衰期、良好(hǎo)的血液循環系統穩定性以及能(néng)介導高(gāo)效的内吞效應等特性。抗體是ADC分子的主要組成部分,占其分子質量的80%以上(shàng),ADC的潛在免疫原性主要來(lái)源于抗體。
早期的ADC藥物,由于采用(yòng)鼠源的抗體,通常會(huì)在病人體内引發較強的免疫反應,産生抗藥抗體,進而導緻療效降低(dī)和(hé)其他(tā)副反應。爲了(le)克服免疫原性這(zhè)一缺點,人鼠嵌合抗體和(hé)人源化抗體應運而生。人鼠嵌合抗體是由鼠源的抗原結合區(qū)(Fab)與人源的恒定區(qū)(Fc)嵌合而成,此種組合大(dà)大(dà)降低(dī)了(le)其免疫原性,采用(yòng)嵌合抗體的ADC也(yě)在臨床上(shàng)展現(xiàn)了(le)良好(hǎo)的療效和(hé)耐受性。普健生物深耕蛋白(bái)抗體領域15餘年,在嵌合抗體制備技術上(shàng)擁有自(zì)主核心技術,與知(zhī)名科研單位、研究院所、醫(yī)藥研發企業成功合作(zuò)相關項目20000+,擁有豐富的多物種(人、小(xiǎo)鼠、大(dà)鼠、兔、羊駝)嵌合抗體生産經驗,能(néng)提供從(cóng)抗原制備,到(dào)抗體生産,标記,檢測,測序等全流程技術支持。如果您想咨詢相關技術或有相關嵌合抗體生産需求,歡迎聯系027-87001869進行交流咨詢。
人源化抗體僅保留鼠源的抗原抗體結合域(complementarity determining region,CDR),Fc片段及其他(tā)框架結構則采用(yòng)人源的,這(zhè)樣也(yě)進一步降低(dī)了(le)抗體的免疫原性。當然,除了(le)利用(yòng)單克隆抗體作(zuò)爲載具的ADC外(wài),也(yě)有很(hěn)多研究嘗試使用(yòng)其他(tā)形式的抗體,例如雙抗、抗體片段或納米抗體等來(lái)開(kāi)發ADC,以進一步提高(gāo)ADC藥物的安全性和(hé)有效性。
ADC藥物目前面臨的挑戰之一是分子質量過大(dà),難于穿越各種生物屏障到(dào)達并穿透實體瘤腫瘤組織,影響其治療實體瘤的效果。爲了(le)提高(gāo)ADC藥物治療實體瘤的效果,研究者們希望通過縮小(xiǎo)抗體框架結構來(lái)降低(dī)ADC的總體分子大(dà)小(xiǎo),增強其腫瘤穿透力,質量小(xiǎo)、穩定性高(gāo)、親和(hé)力強的納米抗體成爲研究者們的不二之選。
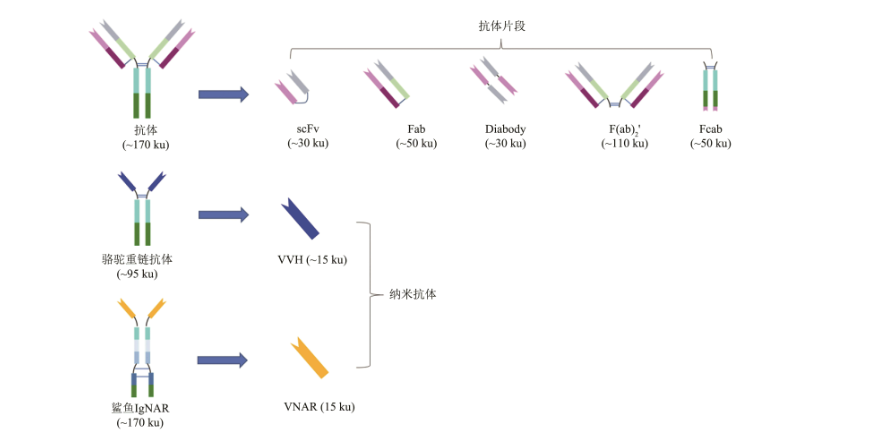
在天然抗體片段中,利用(yòng)Fab來(lái)設計(jì)ADC分子的研究較多。Fab片段包括抗體的單側抗原結合臂,由抗體的輕鏈和(hé)重鏈可變區(qū)加CH1區(qū)段組成,分子質量約爲50 ku,可通過酶解完整抗體或者重組表達獲得。以scFv及其衍生體作(zuò)爲載體則是縮小(xiǎo)版ADC的另一個研究方向,scFv由抗體的輕鏈和(hé)重鏈的可變區(qū)通過一段短肽或者二硫鍵鏈接而成,其分子質量約爲30 ku,且容易在原核細胞中表達,scFv類的ADC已在多個臨床前研究中顯示出良好(hǎo)的可開(kāi)發潛力。
鏈接體負責将ADC的抗體和(hé)細胞毒小(xiǎo)分子鏈接在一起,對(duì)于ADC藥物的安全性和(hé)穩定性至關重要。鏈接體一般包括4個分子片段:抗體連接片段、調節片段、酶降解片段和(hé)自(zì)裂解片段。開(kāi)發者通常依據毒素小(xiǎo)分子的特性以及與抗體連接的方式,并結合對(duì)ADC分子的影響,開(kāi)展綜合分析評估來(lái)篩選上(shàng)述4個片段,最終确定鏈接體的結構。
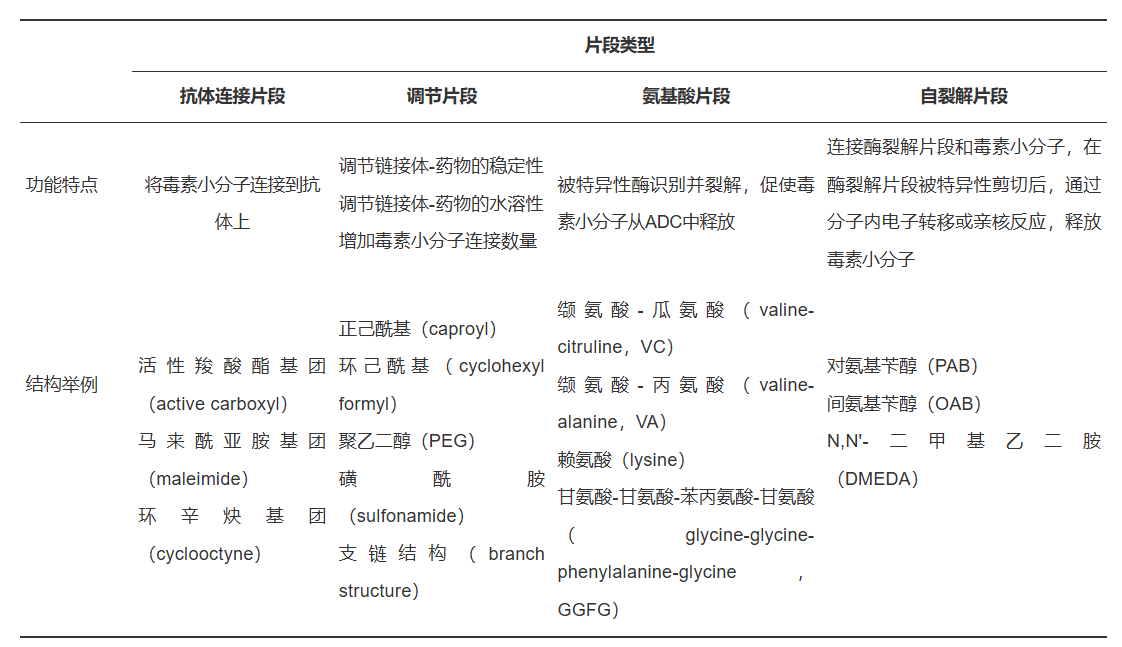
鏈接體的穩定性決定了(le)ADC藥物中的毒素小(xiǎo)分子是傳遞到(dào)腫瘤細胞内部還是有可能(néng)在運輸過程中過早釋放(fàng)并跟随血漿傳遞到(dào)所有組織,顯著影響ADC藥物的安全性和(hé)有效性。ADC藥物的穩定性一般受抗體與鏈接體的偶聯方式、調節片段和(hé)氨基酸片段3個方面的影響,其中,偶聯方式由抗體連接片段決定。

毒素小(xiǎo)分子是ADC藥物中主要負責執行細胞殺傷功能(néng)的組件,它需要具備較高(gāo)的活性使之能(néng)在較低(dī)的劑量下(xià)有效殺傷腫瘤細胞。目前主流的ADC藥物其毒素小(xiǎo)分子的細胞抑制的IC50基本在10-9~10-12 mol/L範圍之間。同時(shí),它還需要具備很(hěn)好(hǎo)的穩定性,使之在循環系統和(hé)溶酶體中保持結構完整和(hé)活性。另外(wài),它還需要分子質量足夠小(xiǎo),免疫原性低(dī),也(yě)需具備方便與鏈接體進行化學反應的位點。

ADC藥物開(kāi)發成功的另一個重要元素是将小(xiǎo)分子組分(鏈接體或鏈接體-毒素小(xiǎo)分子)加載在抗體分子上(shàng)的方式和(hé)技術。偶聯反應策略和(hé)過程,決定了(le)載藥量(drug antibody ratio,DAR)和(hé)載藥分布方式等關鍵質量屬性,與ADC藥物的有效性和(hé)安全性直接相關。
目前的ADC偶聯技術大(dà)緻可以分爲兩種類别,一種是利用(yòng)抗體序列中天然的具備反應活性的氨基酸殘基(如表面賴氨酸的側鏈氨基和(hé)鏈間二硫鍵還原後的巯基)來(lái)介導的偶聯技術;另一類技術,則是通過化學修飾、基因工(gōng)程技術或者酶修飾等手段在抗體特定位點引入可供反應的基團,再偶聯上(shàng)毒素小(xiǎo)分子,實現(xiàn)特定位點偶聯。
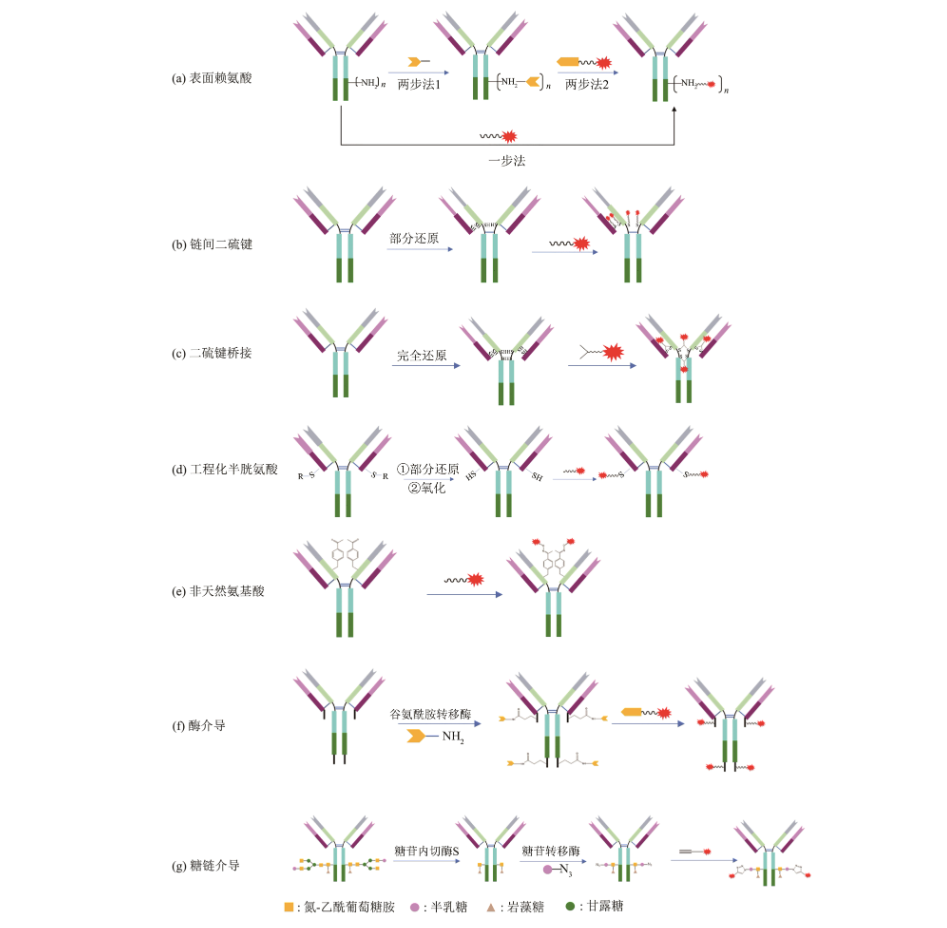
ADC藥物設計(jì)的本質是利用(yòng)抗體的高(gāo)選擇性靶向運輸能(néng)力将具有生物學效應的小(xiǎo)分子藥物高(gāo)效地遞送至病竈發揮治療作(zuò)用(yòng),既是一種新型藥物分子,又是一種靶向遞送系統。在這(zhè)一體系内,抗體、鏈接體、小(xiǎo)分子以及偶聯技術等關鍵要素都需要都需要考慮,針對(duì)靶點的生物學特征以及疾病的特性和(hé)機理(lǐ),選擇高(gāo)特異性抗體、偶聯技術對(duì)于開(kāi)發成功的ADC藥物更是至關重要。普健生物作(zuò)爲您身邊的一站(zhàn)式蛋白(bái)抗體開(kāi)發專家,随時(shí)爲您提供創新的抗體蛋白(bái)制備技術,并基于自(zì)身的自(zì)主産權知(zhī)識幫助ADC研究人員提供高(gāo)質量抗體,助力ADC藥物研究。相信在ADC領域研究者的共同努力下(xià),克服現(xiàn)有ADC的缺點和(hé)挑戰,下(xià)一代的ADC藥物将會(huì)給腫瘤的靶向治療帶來(lái)新驚喜,使更多的腫瘤患者獲益。另外(wài),作(zuò)爲一種遞送系統,相信将來(lái)ADC藥物必将用(yòng)于更加廣泛的領域,如中樞神經疾病、遺傳疾病和(hé)感染性疾病等領域,作(zuò)爲真正高(gāo)效的“魔法子彈”去消滅疾病,拯救生命。

 聯系我們
聯系我們





