時(shí)間匆匆易逝,轉眼間1月份即将結束,在即将過去的1月裏,Nature雜(zá)志又有哪些(xiē)亮(liàng)點研究值得學習呢(ne)?小(xiǎo)編對(duì)相關文(wén)章進行了(le)整理(lǐ),與大(dà)家一起學習!
【1】Nature:利用(yòng)FIND-seq成功分離和(hé)分析在多發性硬化症中發揮關鍵作(zuò)用(yòng)的星形膠質細胞亞群
Iain C. Clark et al. Identification of astrocyte regulators by nucleic acid cytometry. Nature,2023, doi:10.1038/s41586-022-05613-0.
罕見的細胞類型可能(néng)對(duì)人類健康産生不适當的影響。以前的研究已表明(míng)大(dà)腦(nǎo)和(hé)脊髓中的星形膠質細胞的一個亞群可能(néng)是導緻多發性硬化症(MS)的原因。在這(zhè)種疾病中,免疫系統會(huì)攻擊保護神經的覆蓋層。但(dàn)要找到(dào)這(zhè)些(xiē)罕見的細胞并非易事(shì),科學家們需要确定獨特的表面标志物,以将這(zhè)些(xiē)罪魁禍首細胞與其他(tā)細胞區(qū)分開(kāi)來(lái)。單細胞RNA測序可以幫助找到(dào)它們,即使在沒有區(qū)分性的表面标志物的情況下(xià),也(yě)是如此,但(dàn)是這(zhè)種技術可能(néng)變得極其昂貴。
爲了(le)解決這(zhè)個問題,在一項新的研究中,來(lái)自(zì)美(měi)國布萊根婦女醫(yī)院和(hé)加州大(dà)學舊金(jīn)山分校等研究機構的研究人員通過結合核酸細胞儀、微流控技術和(hé)液滴分選,開(kāi)發出FIND-se,可根據數字液滴PCR檢測的mRNA生物标志物的表達來(lái)分離和(hé)分析感興趣的罕見細胞。相關研究結果于2023年1月3日在線發表在Nature期刊上(shàng),論文(wén)标題爲“Identification of astrocyte regulators by nucleic acid cytometry”。

通過使用(yòng)這(zhè)種方法,這(zhè)些(xiē)作(zuò)者非常詳細地分析了(le)驅動中樞神經系統炎症和(hé)神經退化的星形膠質細胞群體。當與其他(tā)工(gōng)具結合使用(yòng)時(shí),FIND-seq确定了(le)由鹽皮質激素受體NR3C2和(hé)NCOR2(nuclear receptor corepressor 2)控制的信号通路,這(zhè)些(xiē)信号通路在小(xiǎo)鼠和(hé)人類的緻病性星形膠質細胞的産生中起着重要作(zuò)用(yòng)。在另一項研究中,他(tā)們利用(yòng)FIND-seq确定了(le)HIV在接受抗逆轉錄病毒療法治療的患者中用(yòng)來(lái)“躲藏”免疫細胞的機制。
【2】Nature:新研究揭示HIV病毒庫細胞如何抵抗人類免疫反應的消除
Weiwei Sun et al. Phenotypic signatures of immune selection in HIV-1 reservoir cells. Nature, 2023, doi:10.1038/s41586-022-05538-8.
感染後不久,HIV-1通過在體内形成病毒庫(viral reservoir)---感染了(le)HIV但(dàn)不積極産生新病毒的細胞,從(cóng)而建立起終身感染。抗逆轉錄病毒療法(ART)降低(dī)了(le)血液中的HIV水(shuǐ)平,但(dàn)是一小(xiǎo)部分感染這(zhè)種病毒的細胞會(huì)無限期地存在,使HIV感染成爲一種不治之症。那些(xiē)能(néng)夠在停止ART治療後重新觸發感染的細胞極其罕見,而且直到(dào)現(xiàn)在還沒有被識别和(hé)表征。
在一項新的研究中,來(lái)自(zì)美(měi)國國家過敏與傳染病研究所、拉根研究所和(hé)麻省總醫(yī)院的研究人員報(bào)告了(le)允許對(duì)單細胞進行多維表征(單細胞蛋白(bái)基因組分析)的新技術的應用(yòng),研究了(le)直接從(cóng)HIV-1感染者身上(shàng)分離的HIV病毒庫細胞。通過這(zhè)種新的技術方法,他(tā)們發現(xiàn)了(le)标志性的表面标志物,這(zhè)可能(néng)解釋了(le)一些(xiē)HIV病毒庫細胞如何能(néng)夠長期存在并抵抗宿主的免疫反應。這(zhè)一發現(xiàn)可能(néng)爲未來(lái)治愈HIV感染的策略提供參考。相關研究結果于2023年1月4日在線發表在Nature期刊上(shàng),論文(wén)标題爲“Phenotypic signatures of immune selection in HIV-1 reservoir cells”。
研究者Mathias Lichterfeld博士說,“高(gāo)通量單細胞測序如今使我們能(néng)夠精确地研究極少數受感染細胞的表面特征,盡管接受了(le)ART治療,這(zhè)些(xiē)細胞仍能(néng)終身存在,并且在停止治療後會(huì)促進HIV反彈。有了(le)這(zhè)些(xiē)知(zhī)識,我們就能(néng)了(le)解它們的易感性和(hé)脆弱性,并能(néng)開(kāi)發出靶向這(zhè)些(xiē)細胞的定制免疫反應。”這(zhè)些(xiē)作(zuò)者收集了(le)5名HIV陽性研究參與者的外(wài)周血細胞。其中的四名參與者已接受了(le)大(dà)約10年的ART治療,還有1人是盡管沒有接受ART治療但(dàn)血液中的HIV水(shuǐ)平卻無法檢測出來(lái)的“精英控制者(elite controller)”。他(tā)們還分析了(le)其中的兩名參與者在接受ART治療僅1-2年後的早期血液樣本。他(tā)們還收集了(le)三名已接受了(le)10~15年ART治療的HIV陽性研究參與者的淋巴結細胞。從(cóng)這(zhè)些(xiē)樣本中,他(tā)們分離出了(le)CD4+記憶T細胞,即在對(duì)感染作(zuò)出反應時(shí)産生的白(bái)細胞,它們是HIV的主要靶細胞。
這(zhè)些(xiē)作(zuò)者開(kāi)發了(le)一種新的實驗策略,稱爲表型和(hé)前病毒測序(phenotypic and proviral sequencing, PheP-Seq),這(zhè)是一種單細胞下(xià)一代測序技術,用(yòng)于評估單個病毒感染細胞表面上(shàng)的生物标志物。利用(yòng)PheP-Seq,他(tā)們分析了(le)53萬多個外(wài)周血細胞和(hé)39.6萬個淋巴結細胞。
【3】Nature:新研究揭示HIV感染的CD4 T細胞病毒庫的HIV沉默和(hé)細胞存活特征
Iain C. Clark et al. HIV silencing and cell survival signatures in infected T cell reservoirs. Nature, 2023, doi:10.1038/s41586-022-05556-6.
了(le)解HIV在抗逆轉錄病毒療法(ART)治療期間如何持續存在,可以推動尋找安全和(hé)可擴展的HIV治愈方法。這(zhè)方面的一個核心例子是潛伏病毒庫概念,在潛伏病毒庫中,一些(xiē)HIV前病毒(HIV provirus)被認爲是通過保持靜止狀态,使得攜帶它們的宿主細胞免于病毒或免疫介導的殺傷而持續存在。支持這(zhè)一概念的證據包括體外(wài)樣本中存在罕見的CD4記憶T細胞,這(zhè)些(xiē)細胞可誘導性地表達HIV,以及來(lái)自(zì)培養模型的表明(míng)HIV轉錄遭受分子阻斷的數據。這(zhè)些(xiē)發現(xiàn)和(hé)其他(tā)發現(xiàn)促使人們開(kāi)發能(néng)夠誘導HIV轉錄的潛伏期逆轉劑(latency-reversing agent, LRA),目的是使得受感染的細胞在體内被消除。
然而,在LRA的臨床試驗中,沒有明(míng)顯減少HIV病毒庫的大(dà)小(xiǎo),這(zhè)強調了(le)在治愈HIV的障礙方面還有很(hěn)多未知(zhī)數。特别重要的是,長期以來(lái)對(duì)HIV感染的CD4 T細胞病毒庫的生物學特性并不清楚。由于血液和(hé)組織中含有靜止病毒的細胞在沒有大(dà)量操縱的情況下(xià)是無法識别的,因此無法确定這(zhè)些(xiē)罕見的細胞是否具有有利于HIV潛伏的特殊屬性,或以其他(tā)方式有助于實現(xiàn)HIV在ART治療期間的持續存在。試圖通過檢測HIV在表型、功能(néng)或解剖學CD4 T細胞亞群中的富集程度來(lái)規避這(zhè)一障礙的研究在某些(xiē)情況下(xià)使用(yòng)先進的單細胞分析---發現(xiàn)多種CD4 T細胞亞群的感染細胞水(shuǐ)平較低(dī),這(zhè)就凸顯了(le)HIV細胞庫的異質性。因此,識别ART治療期間HIV感染的CD4 T細胞的獨特生物特征已成爲HIV治愈研究的一個核心挑戰。
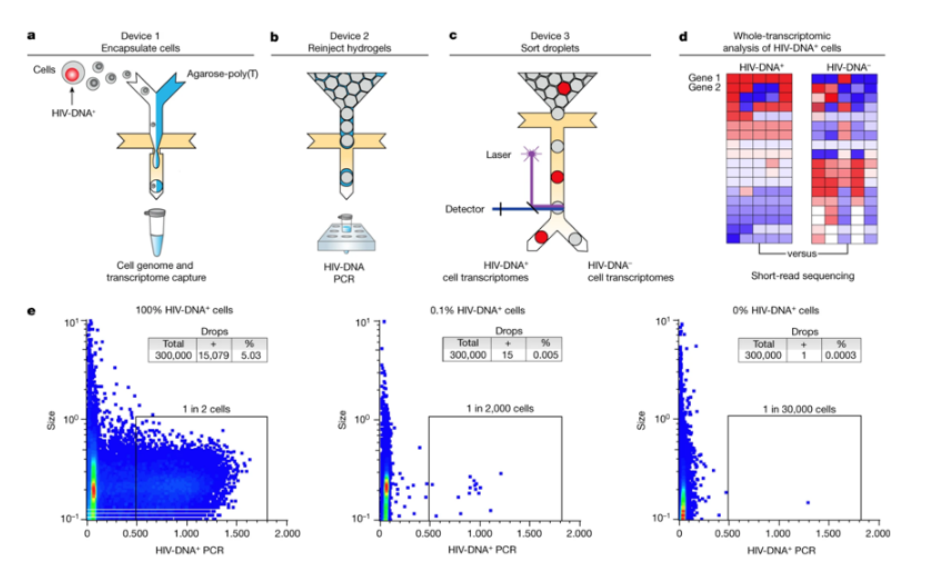
利用(yòng)FIND-seq對(duì)HIV-DNA+ CD4記憶T細胞進行全轉錄組分析
爲了(le)幫助應對(duì)這(zhè)一挑戰,在一項新的研究中,來(lái)自(zì)美(měi)國國家過敏與傳染病研究所和(hé)加州大(dà)學舊金(jīn)山分校等研究機構的研究人員開(kāi)發出一種定制的微流控技術,能(néng)夠直接在體外(wài)對(duì)HIV感染細胞進行無偏見的檢測和(hé)基因表達分析。這(zhè)種技術被稱爲通過核酸檢測和(hé)測序對(duì)細胞進行聚焦探究(focused interrogation of cells by nucleic acid detection and sequencing, FIND-seq),在油包水(shuǐ)液滴中分離出數百萬個細胞,以便立即裂解,然後進行聚腺苷化RNA序列回收,再根據HIV DNA檢測進行分選。這(zhè)種方法從(cóng)含有靜止病毒的細胞中分離出整個轉錄組,不需要體外(wài)潛伏期逆轉,從(cóng)而捕捉到(dào)這(zhè)些(xiē)細胞在自(zì)然狀态下(xià)的全轉錄組圖譜。相關研究結果于2023年1月4日在線發表在Nature期刊上(shàng),論文(wén)标題爲“HIV silencing and cell survival signatures in infected T cell reservoirs”。
【4】Nature:先前感染SARS-CoV-2是否改變人體對(duì)其他(tā)威脅的免疫反應取決于人體的性别
Rachel Sparks et al. Influenza vaccination reveals sex dimorphic imprints of prior mild COVID-19. Nature, 2023, doi:10.1038/s41586-022-05670-5.
長期以來(lái),感染對(duì)免疫系統的長期影響一直吸引着耶魯大(dà)學免疫生物學者John Tsang。在身體面對(duì)一種病原體後,免疫系統是否會(huì)回到(dào)以前的基線?還是說一次感染就改變了(le)它的方式,使它不僅對(duì)熟悉的病毒有反應,而且對(duì)下(xià)一次面臨的新病毒或細菌威脅也(yě)有反應?Tsang長期以來(lái)一直認爲,免疫系統在病毒感染後會(huì)恢複到(dào)之前的穩定基線。2020年COVID-19大(dà)流行的出現(xiàn)使得他(tā)和(hé)同事(shì)們能(néng)夠測試這(zhè)一理(lǐ)論。根據一項新的研究,他(tā)們發現(xiàn),答(dá)案取決于個人的性别。相關研究結果于2023年1月4日在線發表在Nature期刊上(shàng),論文(wén)标題爲“Influenza vaccination reveals sex dimorphic imprints of prior mild COVID-19”。
在這(zhè)項新的研究中, Tsang和(hé)他(tā)的同事(shì)們系統地分析了(le)接種過流感疫苗的健康人的免疫反應。根據這(zhè)些(xiē)數據,他(tā)們随後比較了(le)那些(xiē)從(cóng)未感染過SARS-CoV-2(導緻COVID-19的冠狀病毒)的人和(hé)那些(xiē)感染這(zhè)種病毒後出現(xiàn)過輕微症狀但(dàn)已經康複的人之間的免疫反應。令他(tā)們吃驚的是,他(tā)們發現(xiàn)從(cóng)COVID-19輕度病例中康複的男(nán)性的免疫系統對(duì)流感疫苗的反應比有過輕度病例的女性或從(cóng)未被感染過的男(nán)性和(hé)女性更強。他(tā)們指出實質上(shàng),先前感染SARS-CoV-2的男(nán)性的基線免疫狀态發生了(le)改變,從(cóng)而改變了(le)對(duì)不同于SARS-CoV-2的暴露的反應。
Tsang說,“這(zhè)完全出乎意料。女性通常對(duì)病原體和(hé)疫苗有更強的整體免疫反應,但(dàn)也(yě)更有可能(néng)患上(shàng)自(zì)身免疫性疾病。這(zhè)些(xiē)發現(xiàn)也(yě)可能(néng)與大(dà)流行病早期的一項觀察有關:在感染SARS-CoV-2後,男(nán)性比女性更有可能(néng)死于失控的免疫反應。這(zhè)些(xiē)新的研究結果表明(míng),即使是輕微的COVID-19病例,也(yě)可能(néng)在男(nán)性身上(shàng)引發比女性更強烈的炎症反應,導緻男(nán)性免疫系統發生更明(míng)顯的功能(néng)變化,甚至在康複後很(hěn)久,也(yě)是如此。
【5】兩篇Nature:科學家發現(xiàn)了(le)一種新的CRISPR-Cas剪刀(dāo)---CRISPR–Cas12a2
Oleg Dmytrenko et al. Cas12a2 Elicits Abortive Infection via RNA-triggered Destruction of dsDNA. Nature,2023, doi:10.1038/s41586-022-05559-3.
Jack P. K. Bravo et al. RNA Targeting Unleashes Indiscriminate Nuclease Activity of CRISPR-Cas12a2. Nature,2023, doi:10.1038/s41586-022-05560-w.
像人類一樣,細菌和(hé)古生菌也(yě)會(huì)受到(dào)病毒的攻擊。這(zhè)些(xiē)微生物已進化出自(zì)己的免疫防禦策略,以對(duì)抗它們的病原體。細菌防禦系統,如CRISPR-Cas系統,具有多樣化的蛋白(bái)和(hé)功能(néng),幫助細菌保護自(zì)己免受外(wài)來(lái)入侵者入侵。這(zhè)種免疫防禦基于一個共同的機制:CRISPR核糖核酸(CRISPR ribonucleic acid, crRNA)作(zuò)爲“向導RNA(gRNA)”,幫助檢測外(wài)來(lái)基因組(比如病毒DNA)的區(qū)域,以便進行靶向切割。由crRNA指導的CRISPR相關(Cas)核酸酶可以像一把剪刀(dāo)一樣切割它的靶标:這(zhè)是人類在許多技術中利用(yòng)的一種自(zì)然策略。
來(lái)自(zì)美(měi)國猶他(tā)州立大(dà)學的生物化學學者Thomson Hallmark和(hé)Ryan Jackson與他(tā)們的合作(zuò)者一起,發表了(le)兩篇具有開(kāi)創性的論文(wén)。他(tā)們的研究結果描述了(le)一種新發現(xiàn)的CRISPR-Cas免疫系統的結構和(hé)功能(néng),與更知(zhī)名的讓外(wài)來(lái)基因滅活來(lái)保護細胞的CRISPR-Cas系統不同,這(zhè)種新的系統關閉受感染的細胞來(lái)阻擋感染。相關研究結果于2023年1月4日在線發表在Nature期刊上(shàng),論文(wén)标題分别爲“Cas12a2 elicits abortive infection through RNA-triggered destruction of dsDNA”和(hé)“RNA targeting unleashes indiscriminate nuclease activity of CRISPR–Cas12a2”。
Jackson說,“通過這(zhè)種稱爲CRISPR-Cas12a2的新系統,我們觀察到(dào)了(le)它的結構和(hé)功能(néng)與迄今爲止在CRISPR-Cas系統中觀察到(dào)的結構和(hé)功能(néng)都不同。”作(zuò)爲第一篇論文(wén)第一作(zuò)者的Oleg Dmytrenko博士說,“我們正在探索最初與Cas12a歸類在一起的CRISPR核酸酶,這(zhè)類核酸酶通過識别和(hé)切割侵入性DNA來(lái)保護細菌。一旦我們發現(xiàn)了(le)更多的它們,我們就意識到(dào)它們與Cas12a有足夠的不同,可以進行更深入的研究。這(zhè)種探索使我們發現(xiàn)這(zhè)些(xiē)我們稱之爲Cas12a2的核酸酶,它們不僅與Cas12a有很(hěn)大(dà)的不同,而且與任何其他(tā)已知(zhī)的CRISPR核酸酶也(yě)有很(hěn)大(dà)的不同。”
【6】Nature:通過構建含有20多萬張細胞圖像的數據庫,發現(xiàn)形狀相似的細胞具有類似的内部組織
Matheus P. Viana et al. Integrated intracellular organization and its variations in human iPS cells. Nature,2023, doi:10.1038/s41586-022-05563-7.
在一項新的研究中,來(lái)自(zì)美(měi)國艾倫細胞科學研究所(Allen Institute for Cell Science)的研究人員通過處理(lǐ)數十萬張高(gāo)分辨率圖像,對(duì)人類細胞的内部組織(internal organization)---一種迄今爲止被證明(míng)非常難以定量确定的生物學概念---進行了(le)統計(jì)。他(tā)們還捕捉到(dào)了(le)關于細胞形狀豐富變化的細節,即使是在相同條件下(xià)生長的基因完全一緻的細胞。相關研究結果于2023年1月4日在線發表在Nature期刊上(shàng),論文(wén)标題爲“Integrated intracellular organization and its variations in human iPS cells”。
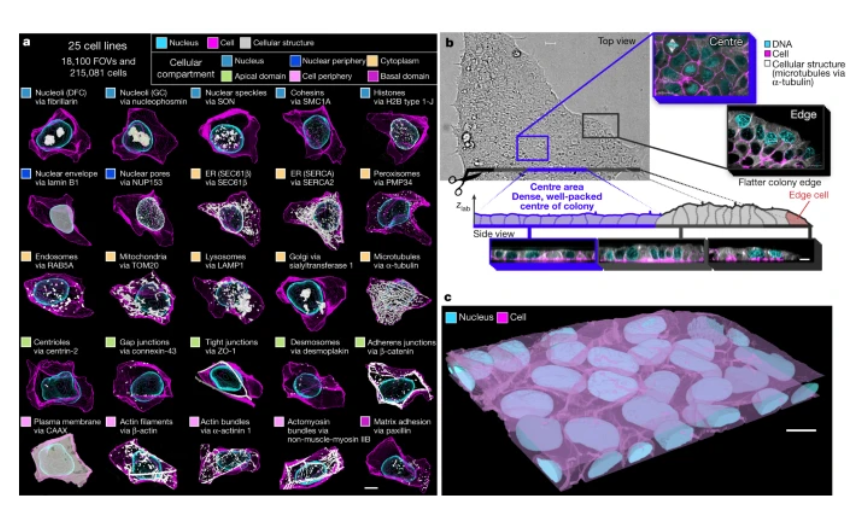
WTC-11 hiPSC單細胞圖像數據集v1包括25種代表位于細胞所有主要區(qū)室的關鍵細胞結構的細胞系
研究者Susanne Rafelski博士說,“細胞的組織方式告訴我們一些(xiē)關于它們的行爲和(hé)身份的信息。當我們都試圖了(le)解細胞在健康和(hé)疾病中如何變化時(shí),這(zhè)個領域一直缺少的是處理(lǐ)這(zhè)種細胞内部組織的嚴格方法。我們還沒有挖掘出這(zhè)種信息。”Rafelski說,這(zhè)項新的研究爲生物學家們提供了(le)一個路線圖,以一種可測量的、定量的方式了(le)解不同類型的細胞的内部組織。它還揭示了(le)這(zhè)些(xiē)作(zuò)者研究的稱爲人類誘導性多能(néng)幹細胞(human induced pluripotent stem cell, iPS細胞)的細胞的一些(xiē)關鍵組織原則。
了(le)解細胞在健康條件下(xià)如何組織自(zì)己---以及“正常”狀态下(xià)所包含的全部變化---可以幫助科學家們更好(hǎo)地了(le)解疾病中的問題所在。這(zhè)項新研究中的圖像數據集、經過基因改造的幹細胞和(hé)代碼都是公開(kāi)的,供科學界中的其他(tā)科學家使用(yòng)。加州大(dà)學舊金(jīn)山分校生物化學與生物物理(lǐ)學教授、艾倫細胞科學研究所科學顧問委員會(huì)成員Wallace Marshall博士說,“使得細胞生物學看(kàn)起來(lái)難以解決的部分原因是,每個細胞看(kàn)起來(lái)都不一樣,即使它們是同一類型的細胞。這(zhè)項新的研究表明(míng),這(zhè)種長期困擾該領域的可變性實際上(shàng)是研究細胞内部組成規則的一個機會(huì)。這(zhè)種方法幾乎可以推廣到(dào)任何細胞,我期望其他(tā)許多人也(yě)能(néng)采用(yòng)同樣的方法。”
【7】Nature:構建出在人類細胞中發現(xiàn)的300多種蛋白(bái)激酶的綜合圖譜
Jared L. Johnson et al. An atlas of substrate specificities for the human serine/threonine kinome. Nature,2023, doi:10.1038/s41586-022-05575-3.
人類最重要的酶之一是蛋白(bái)激酶,它們是調節幾乎所有細胞活動(包括生長、細胞分裂和(hé)代謝(xiè))的信号分子。這(zhè)些(xiē)細胞途徑的功能(néng)失調可導緻多種疾病,特别是癌症。識别參與細胞功能(néng)障礙和(hé)癌症發展的蛋白(bái)激酶可以産生許多新的藥物靶标,但(dàn)是對(duì)于這(zhè)些(xiē)激酶中的絕大(dà)多數,科學家們并沒有清楚地了(le)解它們參與了(le)哪些(xiē)細胞途徑,或者它們的底物是什(shén)麽。
美(měi)國麻省理(lǐ)工(gōng)學院精準癌症醫(yī)學中心主任Michael Yaffe教授說,“我們有大(dà)量的癌症基因組測序數據,但(dàn)我們缺少的是對(duì)癌症中信号通路和(hé)蛋白(bái)激酶激活狀态的大(dà)規模研究。如果我們有這(zhè)些(xiē)信息,我們就會(huì)對(duì)如何治療特定的腫瘤有更好(hǎo)的想法。”在一項新的研究中,Yaffe、耶魯大(dà)學醫(yī)學院的Benjamin E. Turk博士和(hé)威爾康乃爾醫(yī)學院的Lewis C. Cantley博士及其同事(shì)們構建出一個包含在人類細胞中發現(xiàn)的300多種蛋白(bái)激酶的綜合圖譜,并确定了(le)它們可能(néng)靶向和(hé)控制哪些(xiē)蛋白(bái)。這(zhè)些(xiē)信息可能(néng)幫助科學家們破譯許多細胞信号通路,并幫助他(tā)們發現(xiàn)當細胞發送癌變或用(yòng)特定藥物治療時(shí),這(zhè)些(xiē)信号通路會(huì)發生什(shén)麽變化。相關研究結果于2023年1月11日在線發表在Nature期刊上(shàng),論文(wén)标題爲“An atlas of substrate specificities for the human serine/threonine kinome”。
人類基因組包括500多種蛋白(bái)激酶,它們通過給其他(tā)蛋白(bái)标記上(shàng)稱爲磷酸基團的化學修飾來(lái)激活或失活這(zhè)些(xiē)蛋白(bái)。對(duì)于這(zhè)些(xiē)激酶中的大(dà)多數,它們所靶向的蛋白(bái)是未知(zhī)的,盡管對(duì)MEK和(hé)RAF等激酶的研究已導緻了(le)抑制這(zhè)些(xiē)激酶的新癌症藥物,其中MEK和(hé)RAF這(zhè)兩種激酶都參與了(le)控制生長的細胞途徑。爲了(le)确定癌細胞中失調的其他(tā)途徑,這(zhè)些(xiē)作(zuò)者依靠使用(yòng)質譜的磷酸化蛋白(bái)質組學(phosphoproteomics)來(lái)發現(xiàn)癌細胞或健康細胞中磷酸化程度較高(gāo)的蛋白(bái)。然而,在此之前,還沒有一種簡單的方法來(lái)研究質譜數據,以确定哪些(xiē)蛋白(bái)激酶負責磷酸化這(zhè)些(xiē)蛋白(bái)。正因爲如此,這(zhè)些(xiē)蛋白(bái)在疾病中是如何受到(dào)調控或遭受異常調控的仍是未知(zhī)的。
【8】Nature:科學家使用(yòng)鐵(tiě)磁機器人實現(xiàn)靈活高(gāo)效的自(zì)動化病毒檢測
Haisong Lin,Wenzhuo Yu,Kiarash A Sabet,et al. Ferrobotic swarms enable accessible and adaptable automated viral testing,Nature.2022 Nov;611(7936):570-577. doi:10.1038/s41586-022-05408-3
在全球範圍内提高(gāo)病毒診斷和(hé)監測檢測能(néng)力是流行病預防的關鍵。核酸擴增檢測(NAATs)相比抗原抗體檢測具有更優的靈敏度、特異性和(hé)快(kuài)速部署能(néng)力。然而,當前基于 NAAT 的自(zì)動化檢測平台無法靈活實現(xiàn)集成的液體處理(lǐ)、分析和(hé)自(zì)動反饋流程,并且它們的設備笨重、昂貴、試劑損耗大(dà),需要繁瑣的安裝和(hé)維護要求,因此限制了(le)其檢測能(néng)力。近日,來(lái)自(zì)加州大(dà)學洛杉矶分校(UCLA)的研究團隊在《Nature》期刊上(shàng)發表題爲“Ferrobotic swarms enable accessible and adaptable automated viral testing”的文(wén)章。該研究開(kāi)發了(le)一種基于NAAT的自(zì)動化檢測平台,可以在靈活的工(gōng)作(zuò)流程中以并行方式執行可編程的液體處理(lǐ)和(hé)生物分析操作(zuò)。
該平台使用(yòng)一群毫米級大(dà)小(xiǎo)的磁鐵(tiě)作(zuò)爲執行機器人(“鐵(tiě)磁機器人”),它們可以精确操控磁性樣品液滴,并在核酸擴增檢測的基礎上(shàng)高(gāo)保真地提供靈活的工(gōng)作(zuò)流程。該平台将流體設備、硬件和(hé)軟件集成在一塊手掌大(dà)小(xiǎo)的印刷電路基闆(PCB)上(shàng),可同時(shí)對(duì)16個樣本進行檢測。通過對(duì)PCB進行編程後能(néng)夠以全自(zì)動化的方式完成包括樣本輸運、分液、混合、逆轉錄循環介導等溫擴增(RT-LAMP)和(hé)比色法光電檢測在内的全部流程。此外(wài),爲了(le)最大(dà)限度地提高(gāo)篩查效率,研究人員建立了(le)基于患病率的自(zì)适應檢測算(suàn)法。
該算(suàn)法可以确定最佳的檢測模式,并根據方形矩陣集合方案操作(zuò)檢測流程,避免了(le)過于繁瑣的樣本處理(lǐ)程序。随後,研究人員使用(yòng)病毒樣本對(duì)該平台的檢測性能(néng)進行測試,并與RT-PCR檢測(金(jīn)标準)進行比較,結果顯示該平台的檢測靈敏度爲98%,特異性爲100%。
【9】Nature:科學家繪制出靈長類胚胎原腸運動至早期器官發育轉錄組圖譜
Jinglei Zhai,Jing Guo,Haifeng Wan,et al. Primate gastrulation and early organogenesis at single-cell resolution,Nature.2022 Dec;612(7941):732-738. doi:10.1038/s41586-022-05526-y
人的生命始于精子與卵子融合形成受精卵(胚胎期第0天;Embryonic day 0;E0),受精卵經曆卵裂形成囊胚,囊胚在E7左右種植到(dào)母體子宮進一步發育。E14開(kāi)始,胚胎經曆原腸運動,胚胎後部細胞發生大(dà)規模定向遷移,并形成原條細胞。原條細胞進一步分化爲中胚層和(hé)定型内胚層(definitive endoderm),同時(shí)胚胎前部細胞分化爲外(wài)胚層。基于此,胚胎發育成爲具有内胚層、中胚層和(hé)外(wài)胚層的三胚層胚胎。經過複雜(zá)的信号通路調控,三胚層胚胎進一步形成各種器官原基,并最終形成我們身體中包括神經系統、消化系統、呼吸系統、心血管循環系統、泌尿生殖系統等所有系統的各種器官。原腸運動和(hé)三胚層分化異常與多種出生缺陷(如先天性心髒病和(hé)神經管畸形等)和(hé)發育源性疾病相關。探索人類早期胚胎發育過程及機制對(duì)于這(zhè)些(xiē)疾病的診斷和(hé)治療至關重要。
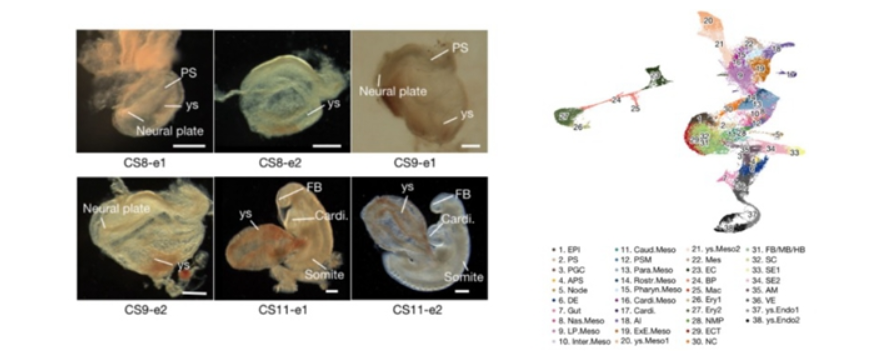
CS8-CS11時(shí)期食蟹猴胚胎的明(míng)場圖(左)與38種主要細胞類群(右)
中國科學院動物研究所王紅(hóng)梅和(hé)郭帆團隊、美(měi)國德克薩斯大(dà)學西南醫(yī)學中心吳軍團隊以及安徽醫(yī)科大(dà)學蔣祥祥團隊合作(zuò)在Nature雜(zá)志上(shàng)發表了(le)題爲Primate gastrulation and early organogenesis at single-cell resolution的研究論文(wén)。該研究以食蟹猴爲模型,利用(yòng)單細胞轉錄組測序和(hé)幹細胞分化模型等,繪制了(le)食蟹猴CS8-CS11時(shí)期(E20-E29)胚胎的單細胞轉錄組圖譜,揭示了(le)原腸運動和(hé)三胚層分化(神經管、體節、腸管等的發育)過程中重要細胞類群的特征及其譜系發生和(hé)調控機制,并比較了(le)齧齒類和(hé)靈長類早期胚胎發育事(shì)件的進化差異。
研究收集了(le)CS8-CS11階段的食蟹猴胚胎,利用(yòng)10X單細胞轉錄組測序技術捕獲了(le)56636個單細胞并進行生物信息學分析,明(míng)确定義了(le)食蟹猴該時(shí)期的38個主要細胞類群,繪制了(le)目前國際上(shàng)第一張靈長類CS8-CS11胚胎的高(gāo)通量單細胞轉錄組圖譜。
【10】Nature:新冠會(huì)改變免疫系統 或會(huì)導緻機體過度的免疫反應
Rachel Sparks, William W Lau, Can Liu, et al. Influenza vaccination reveals sex dimorphic imprints of prior mild COVID-19, Nature.2023 Jan 4. doi:10.1038/s41586-022-05670-5
新冠病毒,通常通過呼吸道(dào)感染人類,并造成呼吸系統和(hé)人體各個器官的損傷。自(zì)2019年底首次爆發至今,新型冠狀病毒仍在全球肆虐,對(duì)世界經濟、社會(huì)造成極大(dà)的負面影響。衆所周知(zhī),急性病毒感染在康複後很(hěn)長一段時(shí)間内會(huì)對(duì)免疫系統産生持久的功能(néng)影響,感染新冠後,免疫系統會(huì)恢複到(dào)之前的狀态嗎?感染後是否會(huì)改變免疫系統面對(duì)其他(tā)病毒的反應方式?
近日,一篇發表在國際雜(zá)志Nature上(shàng)題爲“Influenza vaccination reveals sex dimorphic imprints of prior mild COVID-19”的研究報(bào)告中,來(lái)自(zì)美(měi)國國家過敏和(hé)傳染病研究所等機構的科學家們通過研究發現(xiàn),感染新冠後,即使是輕症,也(yě)會(huì)改變男(nán)性的免疫狀态,使男(nán)性對(duì)流感疫苗的反應更強烈,表明(míng)感染後,在面對(duì)其他(tā)病毒時(shí),男(nán)性會(huì)引發更強烈的炎症反應,導緻男(nán)性免疫系統發生更明(míng)顯的功能(néng)變化,即使在康複後很(hěn)長時(shí)間也(yě)是如此。
在該研究中,研究人員使用(yòng)系統免疫學方法,通過接種流感疫苗,系統性分析了(le)未感染新冠的人和(hé)輕症新冠但(dàn)已康複的人之間的免疫狀态以及對(duì)接種流感疫苗反應;總的來(lái)說,感染新冠後,康複者的T細胞激活特征升高(gāo),單核細胞中先天免疫基因的表達降低(dī)。
特别說明(míng):本文(wén)圖文(wén)轉自(zì)nature,僅做研究分享使用(yòng)。感謝(xiè)每一位作(zuò)者的辛苦付出與創作(zuò),除轉載衆多無法溯源的文(wén)章,我們均在文(wén)章中備注了(le)來(lái)源。如轉載涉及版權等問題,請(qǐng)聯系我們删除,非常感謝(xiè)!

 聯系我們
聯系我們





