2022年12月1日,輝瑞宣布與Roivant Sciences成立一家名爲Vant的新公司,專門(mén)聚焦于TL1A單抗RVT-3101的開(kāi)發和(hé)商業化。該藥物最初由輝瑞開(kāi)發,研發代号爲PF-06480605,目前正在進行潰瘍性結腸炎的IIb期研究階段。當月7号,Prometheus Biosciences宣布其TL1A單抗PRA023兩項II期臨床積極數據,并表示II期數據足以将其推進至III期臨床。So,TL1A有何神奇之處,竟能(néng)引得制藥行業領域巨頭和(hé)新秀們競相跨入同一賽道(dào)對(duì)其進行開(kāi)發,就讓小(xiǎo)普帶着您一探究竟吧!
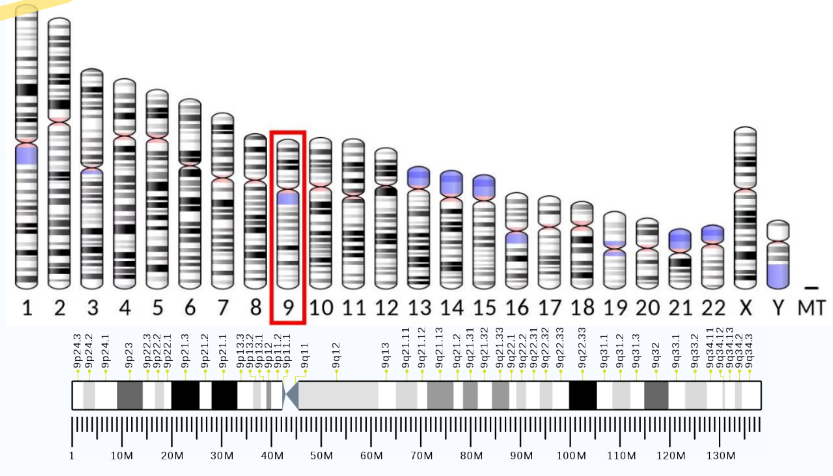
TL1A,亦稱爲血管内皮生長抑制因子(VEGI)和(hé)腫瘤壞死因子超家族成員15(TNFSF15),是人類第9号染色體的TNFSF15基因編碼的蛋白(bái)質。TNFSF15處在染色體9q32位置上(shàng),包含114784652bp-114806039bp堿基對(duì),4個外(wài)顯子區(qū)域。

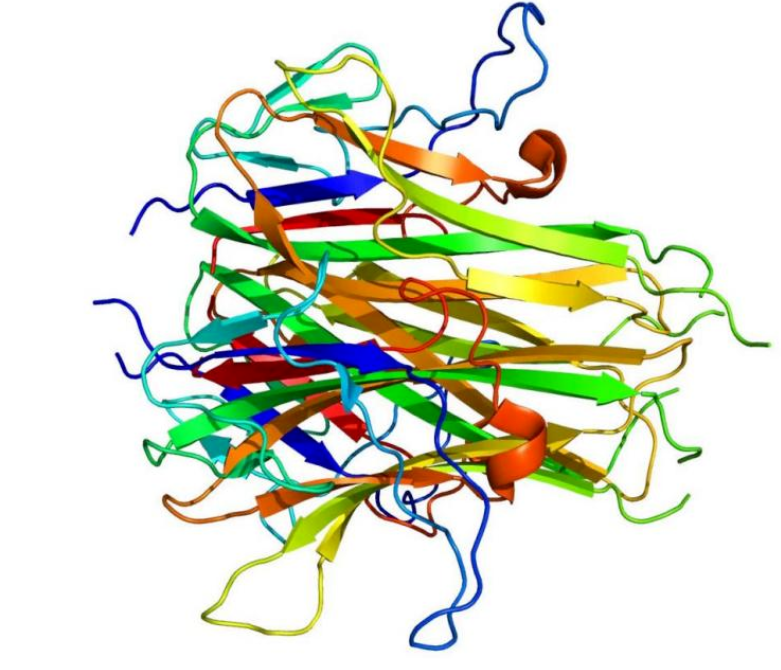
作(zuò)爲一種II型跨膜蛋白(bái),TL1A與TNF家族的其他(tā)成員類似,形成由β夾心組成的穩定非共價同源三聚體結構。TL1A最初以膜結合形式(mTL1A)存在,随後在金(jīn)屬蛋白(bái)酶切割作(zuò)用(yòng)下(xià),以可溶性蛋白(bái)(sTL1A)釋放(fàng)行使功能(néng)。
TL1A由臍靜脈内皮細胞(HUVECs)、單核細胞(Monocytes)、巨噬細胞(Macrophages)、樹突狀細胞(Dendritic cells)、T 細胞(T lymphocyte)、軟骨細胞(Chondrocyte)和(hé)滑膜成纖維細胞(Synovial fibroblast )産生,并可在TNF-α、IL-1和(hé)PMA等促炎細胞因子的刺激下(xià)進行上(shàng)調。其中巨噬細胞中過表達TL1A能(néng)促進TNF-α和(hé)IL-1β的分泌,免疫複合物刺激單核細胞增加對(duì) TL-1A 的分泌,以增強T細胞的免疫反應。TL1A激活并促進DC的遷移,加劇(jù)炎症反應。研究表明(míng),TL1A能(néng)夠促進腫瘤細胞的凋亡,抑制血管内皮細胞生長、刺激淋巴内皮生長、T細胞活化及促進樹突狀細胞成熟,在維持血管、淋巴管穩态和(hé)控制炎性反應等方面發揮重要的作(zuò)用(yòng)。此外(wài),TL1A還可通過抑制血管生成進而抑制腫瘤生長。
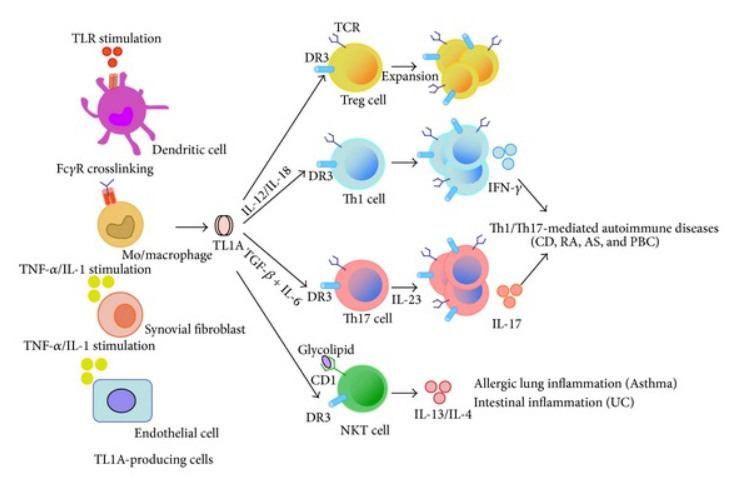
DR3是TL1A在血管内皮細胞和(hé)淋巴内皮細胞的唯一受體,屬于 I 型膜蛋白(bái)。DR3在其細胞質區(qū)域包含一個死亡結構域,參與細胞凋亡過程和(hé)免疫反應,刺激細胞因子的産生,如IL-25,IL-33。TL1A通過結合DR3,會(huì)激活TRADD、TRAF2、RIP及c-IAP1等蛋白(bái)形成信号複合體進而打開(kāi)下(xià)遊信号通路,對(duì)适應性免疫細胞産生多種作(zuò)用(yòng),增加自(zì)然殺傷細胞(NK細胞)中幹擾素γ(IFN-γ)的産生以及NK細胞對(duì)靶細胞的細胞毒性,影響輔助性T細胞、調節性T細胞、B細胞等不同免疫細胞的活化、增殖、分化。TL1A和(hé)DR3還可共同刺激ILC2産生IL-5和(hé)IL-13,參與過敏性肺部炎症的發展過程。ILC3是調節腸道(dào)免疫的關鍵蛋白(bái),而DR3信号通路的激活導緻ILC3功能(néng)失活,引起腸道(dào)炎症。
TL1A與DR3信号通路體現(xiàn)其在自(zì)身免疫和(hé)炎症性疾病的關鍵作(zuò)用(yòng),表明(míng)抑制TL1A-DR3相互作(zuò)用(yòng)可能(néng)是改善自(zì)身免疫性疾病及靶器官局部炎症的有效治療策略。因此,定向開(kāi)發TL1A相關藥物試劑,例如可溶性DR3受體,或針對(duì)TL1A的阻斷抗體将具有重大(dà)的臨床意義。
TL1A可通過Th1和(hé)Th17等細胞增加其受體DR3的表達,以促進炎症。此外(wài),TL1A還可直接激活成纖維細胞,調節纖維化通路。現(xiàn)有數據顯示TL1A可能(néng)成爲治療腸道(dào)炎症的關鍵介質,目前被開(kāi)發用(yòng)于治療潰瘍性結腸炎、克羅恩病、炎症性腸炎等。
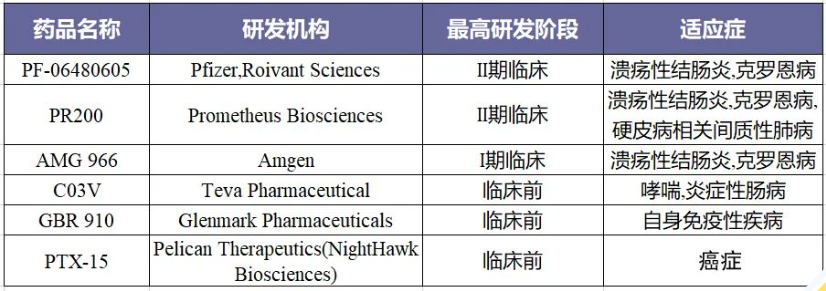
據不完全統計(jì),目前TL1A有關在研的藥物有6種。其中 3 款 TL1A 單抗進入臨床 II 期,除 Prometheus Bio公司PRA023 外(wài),另有Vant制藥TEV-48574、輝瑞PF 6480605(RVT-3101)。其中Prometheus Biosciences透露其針對(duì) TL1A 的藥物在兩項針對(duì)潰瘍性結腸炎或克羅恩病患者的臨床研究中取得了(le)積極結果,他(tā)們計(jì)劃在2023年将其藥物推向關鍵臨床試驗階段。而輝瑞RVT-3101是一種靶向TL1A的全人源單克隆抗體,通過靶向TL1A抑制炎症和(hé)纖維化途徑,現(xiàn)有研究數據顯示其極具成藥潛力。由Amgen公司開(kāi)發的AMG 966是一種雙特異性異種免疫球蛋白(bái)分子,可結合腫瘤壞死因子α(TNFα)和(hé)TNF配體1A(TL1A)。2017年Pelican Therapeutics與KBI Biopharma合作(zuò)開(kāi)發PTX-15融合蛋白(bái),通過模拟抗原特異性T細胞的産生進行免疫治療。GBR 310是一種重組DNA衍生的人源化lgG1 kappa單克隆抗體,GBR 310的拟議(yì)适應症是用(yòng)于治療過敏性哮喘(AA)和(hé)慢性特發性荨麻疹(CIU),2018年7月25日Glenmark Pharmaceuticals披露相關I期臨床數據表明(míng)GBR 310拟議(yì)生物仿制藥與參考産品奧馬珠單抗在藥代動力學、藥效學、安全性和(hé)免疫原性方面具有相似性。上(shàng)述TL1A相關新藥臨床研究都囊括了(le)其他(tā)治療方法未能(néng)充分緩解病情,對(duì)于患有潰瘍性結腸炎、克羅恩病、炎症性腸炎患者,TL1A靶向藥物有望成爲他(tā)們的生命之光。
TL1A靶點開(kāi)發藥物因其獨特的作(zuò)用(yòng)機制在炎症性反應和(hé)纖維化通路方面都發揮重要作(zuò)用(yòng)。多家公司的前期臨床數據讓TL1A作(zuò)爲在潰瘍性結腸炎、克羅恩病等疾病的新靶點市場前景被行業看(kàn)好(hǎo)。我們也(yě)希望針對(duì)TL1A靶點藥物能(néng)與其開(kāi)發者之一Prometheus公司的名字一樣,爲人類引來(lái)攻克頑疾的生命火種。
[1]Richard AC, Ferdinand JR, Meylan F, Hayes ET, Gabay O, Siegel RM. The TNF-family cytokine TL1A: from lymphocyte costimulator to disease co-conspirator. J Leukoc Biol. 2015 Sep;98(3):333-45.
[2]Zhan C, Yan Q, Patskovsky Y, Li Z, Toro R, Meyer A, Cheng H, Brenowitz M, Nathenson SG, Almo SC. Biochemical and structural characterization of the human TL1A ectodomain. Biochemistry. 2009 Aug 18;48(32):7636-45.
Aiba Y, Nakamura M. The role of TL1A and DR3 in autoimmune and inflammatory diseases. Mediators Inflamm. 2013 Dec 21;2013:258164.
[3]Valatas V, Kolios G, Bamias G. TL1A (TNFSF15) and DR3 (TNFRSF25): A Co-stimulatory System of Cytokines With Diverse Functions in Gut Mucosal Immunity. Front Immunol. 2019 Mar 27;10:583.
[4]Xu WD, Li R, Huang AF. Role of TL1A in Inflammatory Autoimmune Diseases: A Comprehensive Review. Front Immunol. 2022 Jul 14;13:891328.

 聯系我們
聯系我們





