LACTB蛋白(bái)全稱爲β-内酰胺酶狀絲氨酸蛋白(bái)酶,多分布于線粒體内部且廣泛表達于哺乳動物組織。LACTB蛋白(bái)因其在線粒體中可自(zì)發性形成多聚體,多以鏈狀形态遊離在線粒體内外(wài)膜間隙中。近年來(lái),已有諸多研究表明(míng),LACTB蛋白(bái)表達受多種生物學過程影響,但(dàn)其具體結構與功能(néng)機制還處于研究初期,對(duì)于LACTB蛋白(bái)結構的解析或可爲其生理(lǐ)功能(néng)研究提供新的方向。
由清華大(dà)學領銜的研究團隊在《Structure》上(shàng)發表相關研究《Structural basis for the catalytic activity of filamentous human Serine beta-lactamase-like protein LACTB》。該研究首次揭示了(le)人源線粒體内LACTB蛋白(bái)結構和(hé)LACTB蛋白(bái)催化機制。

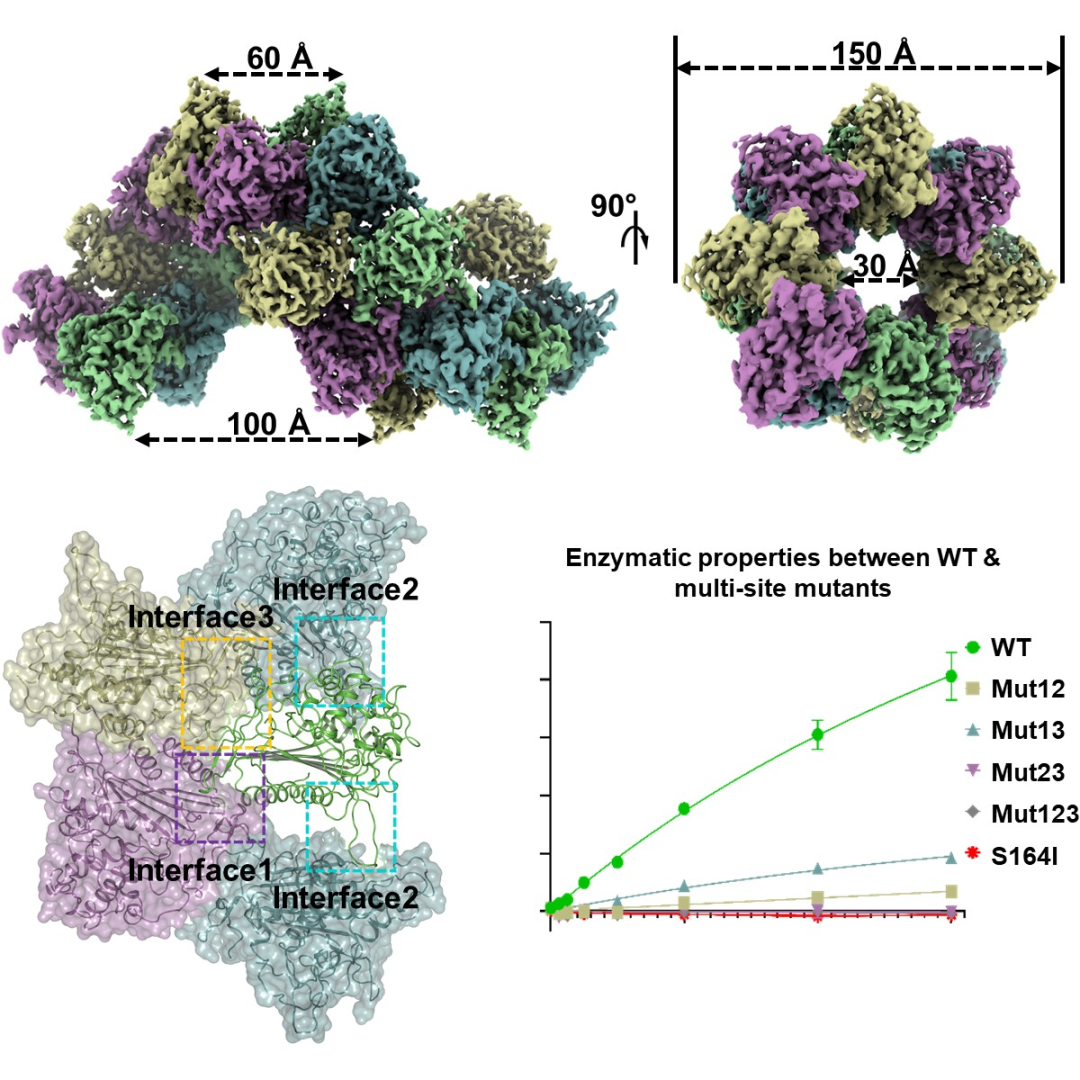
此次研究主要以人源線粒體内成鏈狀絲氨酸蛋白(bái)酶LACTB野生型爲研究對(duì)象。研究發現(xiàn),當破壞LACTB單體蛋白(bái)之間的三種相互作(zuò)用(yòng)界面時(shí),會(huì)通過抑制該蛋白(bái)酶活中心正電平面的強化過程或破壞底物/産物的潛在通道(dào)來(lái)影響該酶的反應動力學常數。研究人員還發現(xiàn),在LACTB蛋白(bái)與抑制劑Z-AAD-CMK結合狀态下(xià),Z-AAD-CMK通過天冬氨酸羰基碳與LACTB蛋白(bái)的164位絲氨酸側鏈羟基氧共價連接。
另外(wài),研究人員針對(duì)LACTB蛋白(bái)進行了(le)蛋白(bái)鏈狀結構分析和(hé)LACTB截短體蛋白(bái)的結構分析,
LACTB蛋白(bái)鑒于其靈活性很(hěn)難獲取到(dào)中間區(qū)域密度;而中間區(qū)域缺失的LACTB截短體蛋白(bái)不僅可保持PBP-βLs結構形式不變,并且其形成多聚的形式也(yě)變化不大(dà)。随後,研究人員針對(duì)LACTB截短體蛋白(bái)進行了(le)功能(néng)性實驗驗證,結果表明(míng),LACTB截短體蛋白(bái)對(duì)其底物Ac-YVAD-AMC多肽的水(shuǐ)解活性喪失。這(zhè)說明(míng),LACTB蛋白(bái)的中間區(qū)域對(duì)其基本PBP-βLs結構的維持及多聚成鏈中發揮作(zuò)用(yòng)不大(dà),但(dàn)在LACTB蛋白(bái)發揮底物水(shuǐ)解功能(néng)時(shí)起到(dào)了(le)至關重要的作(zuò)用(yòng)。
該研究對(duì)于理(lǐ)解LACTB蛋白(bái)多聚鏈狀結構與其酶活功能(néng)之間的關系具有重要意義,爲後續LACTB蛋白(bái)相關疾病的緻病機理(lǐ)研究鋪平了(le)道(dào)路,并爲今後治療與LACTB蛋白(bái)相關的癌症提供了(le)研究方向及爲藥物設計(jì)靶點提供了(le)重要依據。
相關論文(wén)信息:
https://doi.org/10.1016/j.str.2022.02.007
參考文(wén)獻
1.Keckesova, Z., et al., LACTB is a tumour suppressor that modulates lipid metabolism and cell state. Nature, 2017. 543(7647): p. 681-686.

 聯系我們
聯系我們





