Selli等人發現(xiàn),雖然攜帶CD28的嵌合抗原受體(CAR)T細胞通過腫瘤或慢性感染刺激下(xià)發生的經典事(shì)件,從(cóng)而發生功能(néng)障礙和(hé)耗竭,但(dàn)攜帶4-1BB的CAR-T細胞則以由轉錄因子FOXO3驅動的不同方式發生功能(néng)障礙。
十多年前,CAR-T細胞被證明(míng)對(duì)B細胞惡性腫瘤具有顯着的療效。它們均靶向B細胞分子CD19,并帶有CD28或4-1BB中1個共刺激分子的胞内信号域。研究者假設将共刺激結構域并入CAR可改善持久性和(hé)功能(néng),從(cóng)而改善抗腫瘤作(zuò)用(yòng)。由于這(zhè)些(xiē)初始産品取得顯著的初步成功,美(měi)國食品和(hé)藥物管理(lǐ)局批準的所有6種構建物,包括針對(duì)骨髓瘤漿細胞表達的b細胞成熟抗原的構建物,以及臨床開(kāi)發中的大(dà)多數其他(tā)CAR,包括各種适應症,都包含這(zhè)兩個信号域中的一個。
由于CAR以高(gāo)親和(hé)力識别抗原,并且由組成型啓動子表達,因此研究者早期注意到(dào),抗原的持續刺激(有時(shí)甚至是CAR的高(gāo)水(shuǐ)平表達)可導緻T細胞功能(néng)障礙。這(zhè)些(xiē)功能(néng)失調的T細胞在抗原刺激後的細胞毒性、細胞因子産生和(hé)增殖能(néng)力降低(dī);這(zhè)可以通過中斷信号轉導中的休息來(lái)克服。在患者中,高(gāo)腫瘤負荷與應答(dá)降低(dī)和(hé)T細胞功能(néng)障礙增加相關。到(dào)目前爲止,這(zhè)種功能(néng)障礙被認爲在本質上(shàng)與T細胞“耗竭”是相同的現(xiàn)象,而T細胞“耗竭”已經在接受檢查點阻斷治療的慢性病毒感染和(hé)癌症中得到(dào)了(le)廣泛描述。
Selli等通過重複體外(wài)刺激攜帶CD28或4-1BB胞内信号域的CD19導向的CAR T細胞來(lái)模拟慢性激活,從(cóng)而産生功能(néng)障礙,然後對(duì)轉錄、表觀遺傳和(hé)表型程序進行了(le)全面分析。每48小(xiǎo)時(shí)用(yòng)低(dī)效靶比的新腫瘤細胞刺激CAR T細胞。2周後,CAR T細胞失去了(le)殺傷抗原陽性靶點的能(néng)力,不能(néng)再産生細胞因子,也(yě)不能(néng)再增殖。接下(xià)來(lái),他(tā)們利用(yòng)飛(fēi)行時(shí)間的多參數細胞測定法從(cóng)表型上(shàng)研究了(le)這(zhè)些(xiē)功能(néng)失調的CAR T細胞。研究發現(xiàn),含有CD28的CAR - T細胞具有典型T細胞耗竭的特征,包括PD-1、TIGIT、LAG3、TIM3和(hé)CTLA4的重新表達(見圖)。相比之下(xià),攜帶4-1BB CARs的功能(néng)失調T細胞占據不同的T分布随機鄰居嵌入空(kōng)間,其表面表達更高(gāo)的CD62L和(hé)CD25。使用(yòng)RNA測序檢查這(zhè)些(xiē)功能(néng)失調的CAR T細胞的轉錄程序顯示,基于CD28的CAR T細胞高(gāo)度富集與耗竭相關的基因,而基于4- 1BB的功能(néng)失調的CAR T細胞沒有典型的耗竭标簽。
最近關于T細胞衰竭的研究強調,這(zhè)種狀态是由特定的表觀遺傳改變決定的。研究人員還使用(yòng)染色質開(kāi)放(fàng)性測序技術(ATAC-seq)證實了(le)這(zhè)些(xiē)差異,特别是PD1編碼基因(PDCD1)的染色質可及性測定法,在基于CD28的CAR T細胞中,這(zhè)看(kàn)起來(lái)像是典型的耗竭,但(dàn)在基于4- 1BB的CAR T細胞中并非如此。研究人員随後使用(yòng)縱向單細胞RNA測序,确定大(dà)多數功能(néng)失調的4-1BB CAR T細胞是由一組涉及細胞毒性(GNLY、CCL5、PRF1、GZMA、GZMK、CTSW)、自(zì)然殺傷細胞特性(KLRK1、KLRC2)和(hé)T細胞分化(ID2)的獨特基因定義,他(tā)們将這(zhè)些(xiē)基因稱爲TBBD标簽。有趣的是,他(tā)們的TBBD标簽在接受抗CD19 /4- 1BB CAR構建物Tisagenlecleucel治療的1例患者中得到(dào)了(le)證實,該患者雖然血液中有CAR T細胞,但(dàn)淋巴瘤仍發生進展。
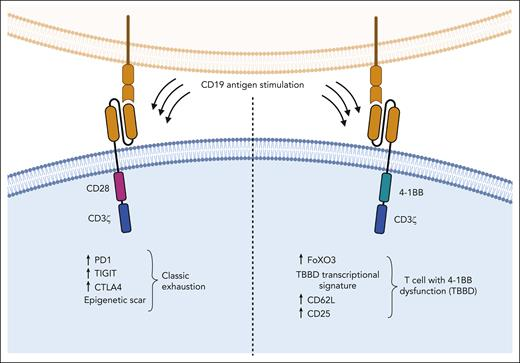
攜帶不同共刺激結構域的CAR-T細胞在慢性刺激後功能(néng)失調時(shí)表現(xiàn)出不同的轉錄、表觀遺傳和(hé)表型特征。攜帶4-1BB共刺激結構域的CAR-T細胞重新激活FOXO3,其驅動一種不同于經典T細胞衰竭的新功能(néng)障礙程序。
爲了(le)了(le)解這(zhè)種功能(néng)障礙的新型分子程序的起源,研究團隊研究了(le)随着時(shí)間的推移轉錄因子結合的可及性。正如預期的那樣,CD28-CAR功能(néng)障礙增加了(le)Jun:Fos(AP1)結合的可及性,但(dàn)相反,4-1BB-CAR功能(néng)障礙打開(kāi)了(le)同源盒(HOX)和(hé)叉頭框(FOX)位點,并且小(xiǎo)的條理(lǐ)性RNA測序數據顯示FOXO3活性高(gāo)。此外(wài),在機制研究中,通過CRISPR/Cas幹擾FOXO3可使患者對(duì)重複抗原刺激後的功能(néng)障礙産生抵抗,相反,FOXO3過表達顯著減少了(le)4-1BB(而非CD28) CAR T細胞在重複抗原刺激下(xià)的擴增。在小(xiǎo)鼠異種移植應激模型中,注射極少量的CAR T細胞治療較高(gāo)的腫瘤負荷,攜帶4-1BB胞内信号域的FOXO3敲除CAR T細胞改善了(le)生存。
值得注意的是,研究人員通過深度技術探究(從(cóng)高(gāo)維細胞測定到(dào)縱向單細胞RNA測序)發現(xiàn)了(le)一種新的分子機制,同時(shí)仍然使用(yòng)相對(duì)簡單的體外(wài)模型(重複抗原刺激)。分子程序本身和(hé)FOXO3的重新激活是有趣的,可能(néng)在自(zì)然界中并不常見。在自(zì)然生物學中,4-1BB刺激與T細胞受體(TCR)刺激在時(shí)間上(shàng)分離,而TCR表達本身随着抗原暴露而循環,因此減少了(le)緊張信号傳導的可能(néng)性。未來(lái)的研究可能(néng)包括在更多接受Tisagenlecleucel治療但(dàn)無應答(dá)的患者中進一步驗證TBBD轉錄特征和(hé)FOXO3活性。同樣,無論疾病狀态如何,我們都應基于對(duì)新生CD19+ B細胞的長期暴露,進一步了(le)解Tisagenlecleucel在患者中是否會(huì)耗竭。有趣的是,在接受治療的前2例患者(這(zhè)2例患者均有長期緩解)中,長期暴露于新生B細胞被認爲在Tisagenlecleucel持續10年的過程中發揮了(le)作(zuò)用(yòng)。此外(wài),當BCMA陽性骨髓瘤患者在使用(yòng)BCMA導向的CAR T細胞持續存在的情況下(xià)複發時(shí),對(duì)于對(duì)其他(tā)抗原具有特異性的、攜帶4- 1BB的CAR T細胞(例如已批準用(yòng)于多發性骨髓瘤的兩種靶向B細胞成熟抗原[BCMA]的CAR T細胞)是否也(yě)表現(xiàn)出TBBD标簽和(hé)FOXO3再激活,這(zhè)将是該領域的興趣。最後,在機制水(shuǐ)平,研究FOXO3敲除或C-Jun過表達在減少CAR-T細胞耗竭方面是否更有效将是有趣的。
參考文(wén)獻
1.Selli ME, Landmann JH, Terekhova M, et al. Costimulatory domains direct distinct fates of CAR-driven T-cell dysfunction. Blood. 2023;141(26):3153-3165.
2.Kochenderfer JN, Dudley ME, Feldman SA, et al. B-cell depletion and remissions of malignancy along with cytokine-associated toxicity in a clinical trial of anti-CD19 chimeric-antigen-receptor-transduced T cells. Blood. 2012;119(12):2709-2720.
3.Porter DL, Levine BL, Kalos M, Bagg A, June CH. Chimeric antigen receptor-modified T cells in chronic lymphoid leukemia. N Engl J Med. 2011;365(8):725-733.
4.Brentjens RJ, Davila ML, Riviere I, et al. CD19-targeted T cells rapidly induce molecular remissions in adults with chemotherapy-refractory acute lymphoblastic leukemia. Sci Transl Med. 2013;5(177):177ra38.
5.Weber EW, Parker KR, Sotillo E, et al. Transient rest restores functionality in exhausted CAR-T cells through epigenetic remodeling. Science. 2021;372(6537):eaba1786.
6.Locke FL, Rossi JM, Neelapu SS, et al. Tumor burden, inflammation, and product attributes determine outcomes of axicabtagene ciloleucel in large B-cell lymphoma. Blood Adv. 2020;4(19):4898-4911.
7.Blank CU, Haining WN, Held W, et al. Defining 'T cell exhaustion'. Nat Rev Immunol. 2019;19(11):665-674.
8.Sen DR, Kaminski J, Barnitz RA, et al. The epigenetic landscape of T cell exhaustion. Science. 2016;354(6316):1165-1169.
9.Melenhorst JJ, Chen GM, Wang M, et al. Decade-long leukaemia remissions with persistence of CD4(+) CAR T cells. Nature. 2022;612(7941):E22.
10.Lynn RC, Weber EW, Sotillo E, et al. c-Jun overexpression in CAR T cells induces exhaustion resistance. Nature. 2019;576(7786):293-300.

 聯系我們
聯系我們





