随着越來(lái)越多的重組抗體應用(yòng)于傳染性疾病中,人們對(duì)于此類抗體藥物越來(lái)越關注,尤其是針對(duì)目前尚無疫苗的高(gāo)危人群和(hé)病原體的重組抗體。然而,表現(xiàn)爲機會(huì)性或潛伏性感染的病原體表達複雜(zá)的毒力相關蛋白(bái)陣列,并擅長躲避免疫應答(dá)。一些(xiē)病原體已經發展出有選擇性地破壞抗體的策略,而另一些(xiē)則制造誘餌表位,欺騙宿主免疫系統産生抗體,這(zhè)些(xiē)抗體輕則沒有保護作(zuò)用(yòng),重則推進了(le)發病機制。以重組抗體爲代表的抗體工(gōng)程策略可以通過訪問保守的中和(hé)表位、生成Fc結構域來(lái)阻止捕獲或降解,甚至訪問隐藏在細胞内的病原體,從(cóng)而阻礙這(zhè)些(xiē)努力。病原體耐藥抗體的設計(jì)可以增強對(duì)這(zhè)些(xiē)複雜(zá)病原體的保護并指導疫苗免疫原的開(kāi)發。設計(jì)針對(duì)特定病原體防禦機制的重組抗體可以從(cóng)三個方面着手:靶向屏蔽脆弱表位的病原體、靶向破壞抗體 FC 功能(néng)的病原體、靶向破壞宿主免疫力的病原體,今天我們主要介紹如何針對(duì)病原體保護脆弱的抗原表面進行抗體的設計(jì)和(hé)重組。
針對(duì)病原體保護脆弱的抗原表位
抗體靶向的一個關鍵要求是易于識别病原體相關分子。最佳靶點由不同組織和(hé)感染的多個階段由大(dà)多數菌株表達表達,易于獲得,這(zhè)些(xiē)靶點要麽在疾病進展中發揮關鍵功能(néng),要麽募集調理(lǐ)素介導病原體破壞。這(zhè)爲病原體隐藏這(zhè)些(xiē)脆弱的表位提供了(le)選擇壓力。對(duì)中和(hé)抗體和(hé)非中和(hé)抗體複合物中病毒糖蛋白(bái)的結構-功能(néng)研究揭示了(le)抗體逃逸的共同機制,包括抗原漂移、表位屏蔽和(hé)免疫向優勢但(dàn)非保護性表位的定向。這(zhè)些(xiē)見解結合新的表位特異性和(hé)靶點未知(zhī)的抗體發現(xiàn)工(gōng)具,支持設計(jì)更有彈性的藥物性抗體。
結合抵抗抗原漂移的保守表位的抗體
人們在确定靶向包膜病毒(包括RSV、流感病毒、HIV和(hé)冠狀病毒)保守表位的抗體方面已經投入了(le)大(dà)量工(gōng)作(zuò),從(cóng)而開(kāi)發出可預防多種毒株的廣譜反應性抗體和(hé)疫苗。這(zhè)些(xiē)病毒利用(yòng)融合糖蛋白(bái)入侵宿主細胞,首先附着在宿主細胞受體上(shàng),然後經曆巨大(dà)的構象變化将病毒和(hé)宿主的膜結合在一起并介導膜融合。确定中和(hé)抗體的努力集中在受體結合域,以阻斷這(zhè)種初始相互作(zuò)用(yòng)。
事(shì)實上(shàng),這(zhè)些(xiē)區(qū)域具有高(gāo)度的免疫原性,結合關鍵表位的抗體可有效中和(hé)。對(duì)RSV F融合蛋白(bái)進行的重要研究表明(míng),融合前構象比融合後構象包含更多的中和(hé)表位,并且這(zhè)些(xiē)表位可能(néng)在構象變化過程中丢失。抗體D25與融合前位點Ø結合,從(cóng)而阻斷受體結合,中和(hé)RSV的效力比目前臨床使用(yòng)的識别融合後表位的抗體(帕利珠單抗)高(gāo)50倍。D25作(zuò)爲Nirsevimab正在通過臨床試驗取得進展,其半衰期Fc延長,可以單次給藥。
鑒定這(zhè)種強效抗體對(duì)于其他(tā)病毒來(lái)說一直具有挑戰性,部分原因是受體結合域的高(gāo)度序列變異,這(zhè)通常會(huì)限制抗體的中和(hé)作(zuò)用(yòng)僅局限于少數毒株。
在SARS-CoV-2中,多種抗體阻斷梭原刺突蛋白(bái)與ACE2受體獲得了(le)緊急使用(yòng)授權,但(dàn)由于新變異株的突變而迅速失效。因此需要鑒定參與保守殘基的中和(hé)抗體,通常在隐秘的表位中,不易受到(dào)抗原漂移的影響。納米抗體在這(zhè)種情況下(xià)特别有用(yòng),因爲它們的小(xiǎo)尺寸和(hé)長CDR3環可以進入IgG抗體無法獲得的表位,因此不太容易受到(dào)人體免疫系統壓力引起的抗原漂移的影響。一項針對(duì)免疫駱駝的努力确定了(le)數百個CDR3納米抗體家族,靶向穗峰。其中包括具有皮摩爾親和(hé)力的強效納米抗體,可在動物模型中中和(hé)多種SARS-CoV-1和(hé)2毒株,而其高(gāo)穩定性支持經鼻給藥,從(cóng)而在感染部位達到(dào)治療濃度。爲了(le)誘導抗體與保守的中和(hé)第4類和(hé)1/4類表位結合,用(yòng)含有來(lái)自(zì)8株菌株的受體結合域嵌合體的納米顆粒進行免疫似乎有希望。這(zhè)一領域的巨大(dà)努力凸顯了(le)找到(dào)中和(hé)可變受體結合域的交叉反應性抗體的挑戰和(hé)前景。
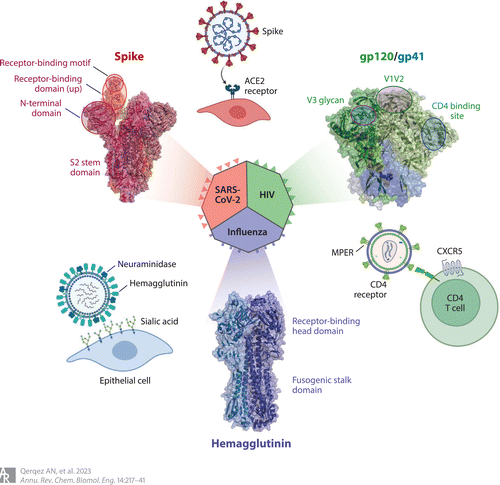
Figure 1 Key domains and antibody-targeted vulnerable sites in viral fusogen proteins from SARS-CoV-2, HIV-1, and influenza. For each virus, the overall interactions with the respective cellular receptor are shown along with the structure of each corresponding fusogen, indicating key domains and epitopes. Structures for influenza hemagglutinin H3 are from PDB 4FNK, for the HIV-1 envelope from PDB 5CJX, and for the SARS-CoV-2 spike from PDB 7SXT. Abbreviation: MPER, membrane-proximal external region. Adapted from images created with BioRender.
鑒定與罕見的、保守的中和(hé)表位結合的抗體的另一種方法是鑒定那些(xiē)與功能(néng)受限的表位結合的抗體。在融合糖蛋白(bái)中,這(zhè)包括發生構象變化的高(gāo)度保守區(qū)域,或稱爲莖、柄或S2域。在一項感染研究中,在流感中,結合該區(qū)域的血清抗體與保護作(zuò)用(yòng)相關,而且這(zhè)些(xiē)抗體似乎不太容易被病毒逃逸大(dà)多數中和(hé)抗體結合的是血凝素受體結合頭結構域内的毒株特異性表位,而與融合柄結合的抗體可通過抑制低(dī)ph核内體中膜融合所需的構象重排和(hé)招募Fc效應蛋白(bái)功能(néng)來(lái)中和(hé)多個病毒群(Figure 1)。Guthmiller等發現(xiàn)了(le)一個高(gāo)度保守的血凝素錨定表位,該表位在人類B記憶庫中常見。結合這(zhè)一表位的抗體可穩定病毒膜附近的血凝素,從(cóng)而中和(hé)廣泛的H1毒株、潛在的大(dà)流行H2和(hé)H5毒株以及常見的A388V柄逃逸變異株。同樣,3A3抗體和(hé)7A3納米抗體均靶向高(gāo)度保守的β冠狀病毒鉸鏈,從(cóng)而結合廣泛的毒株,而且7A3已被證明(míng)保護表達ACE2的人小(xiǎo)鼠免受Delta SARS-CoV-2感染。結合保守幹性表位的抗體可以識别廣泛的毒株,但(dàn)它們對(duì)保護作(zuò)用(yòng)的貢獻尚未完全清楚。
這(zhè)些(xiē)成功激發了(le)人們對(duì)識别其他(tā)靶蛋白(bái)(包括複雜(zá)細菌病原體表達的蛋白(bái))上(shàng)高(gāo)度保守的表位的興趣。結合細菌表面的保護性抗體可通過Fc受體直接介導吞噬作(zuò)用(yòng)或激活補體,導緻C3b調理(lǐ)作(zuò)用(yòng),繼而吞噬作(zuò)用(yòng)或直接溶解細菌。一個關鍵限制是抗原表面密度必須足夠高(gāo),以支持觸發這(zhè)些(xiē)事(shì)件所需的抗體和(hé)受體聚集。就腦(nǎo)膜炎奈瑟菌而言,每個細胞似乎都需要>757因子H蛋白(bái)。目标蛋白(bái)也(yě)應該是必需的,因爲殺菌抗體可導緻抗原丢失,正如觀察到(dào)的蛋白(bái)百日咳黏着素(pertactin)一樣,許多百日咳鮑特菌疫苗中含有百日咳黏着素。爲此,通過篩選人類供體細胞,發現(xiàn)了(le)與保守和(hé)保護性肺炎鏈球菌抗原肺炎鏈球菌組氨酸三聯體蛋白(bái)PhtD結合的抗體。這(zhè)些(xiē)蛋白(bái)與來(lái)自(zì)幾種血清型莢膜細菌的抗原結合,保護小(xiǎo)鼠免受原發性和(hé)繼發性攻擊,爲單獨靶向>100不同莢膜血清型提供了(le)一種潛在的替代方案。同樣,萊姆病病原體伯氏疏螺旋體(Borrelia burgdorferi)外(wài)表面蛋白(bái)VlsE(表達的可變主要蛋白(bái)樣序列)的保守區(qū)域已被确定,但(dàn)它們的治療潛力仍有待确定。這(zhè)些(xiē)報(bào)告令人興奮,因爲它們提示結合細菌表面蛋白(bái)的抗體可用(yòng)于補充結合細菌碳水(shuǐ)化合物的抗體。
進入隐藏表位的抗體
抗體可以接觸到(dào)溶劑暴露的表位,這(zhè)對(duì)抗原漂移産生壓力,從(cóng)而逃避抗體結合。因此,病原體可以遮蔽保守的和(hé)功能(néng)重要的表位。一種策略是提出高(gāo)免疫原性但(dàn)無保護性的誘騙表位,以限制抗體對(duì)鄰近易損表位的識别。
與這(zhè)一高(gāo)度保守的表位結合的抗體很(hěn)罕見,因爲它毗鄰一個免疫顯性和(hé)高(gāo)可變的環。從(cóng)免疫原中删除該環可誘導産生高(gāo)水(shuǐ)平IgG22樣抗體,從(cóng)而保護小(xiǎo)鼠免受不同β-人冠狀病毒的感染。類似地,人巨細胞病毒gB融合原在抗原結構域2中包含一個高(gāo)度保守的位點1(跨越第69 ~ 78位殘基),該位點可誘導産生有效的保護性抗體。該位點被與相鄰位點2(跨越殘基50 ~ 54)和(hé)免疫顯性抗原域1結合的抗體有效掩蓋,這(zhè)兩個位點都主要引起非中和(hé)抗體。根據IgG22報(bào)告推斷,未來(lái)的免疫原設計(jì)工(gōng)作(zuò)可能(néng)能(néng)夠将免疫應答(dá)集中在gB位點1和(hé)其他(tā)抗原中的次優勢但(dàn)具有保護作(zuò)用(yòng)的表位。
第二種策略是使用(yòng)糖基化位點來(lái)屏蔽脆弱的表位。HIV-1包膜被>25 n連接的糖基化位點修飾,這(zhè)些(xiē)糖基化位點保護了(le)廣泛中和(hé)表位,包括V1V2位點,即gp120上(shàng)的第一個和(hé)第二個可變區(qū)(圖1)。在RV144疫苗的Ⅲ期試驗中,V1V2結合抗體介導Fc效應功能(néng)(抗體依賴性細胞吞噬和(hé)補體激活),而不是廣泛中和(hé)作(zuò)用(yòng),從(cóng)而與保護作(zuò)用(yòng)相關。該區(qū)域在許多供體中引起交叉反應性抗體,但(dàn)需要廣泛的體細胞超突變和(hé)長CDRH3環才能(néng)訪問表位。與先前的結合V1V2的抗體PG9不同,CAP256-VR26抗體系結合V1V2區(qū)域,并在耐受刺突聚糖N160和(hé)N156丢失的情況下(xià)産生了(le)有效的fc介導的保護作(zuò)用(yòng)。其他(tā)廣泛的HIV中和(hé)抗體需要多年的成熟和(hé)廣泛的體細胞超突變,與之不同,CAP256-VRC26.08包含的突變要少得多,這(zhè)可以簡化通過接種疫苗産生類似抗體的策略。
第三種策略是結構阻斷易損表位。例如,受體結合表位可僅在需要與受體結合時(shí)短暫暴露。SARS-CoV-1/-2 交叉反應抗體CR3022已報(bào)告了(le)這(zhè)一點,該抗體與一個隐表位結合,當受體結合結構域處于下(xià)降狀态時(shí)隐藏,但(dàn)當該域轉變爲上(shàng)狀态并與ACE2受體結合時(shí)隐表位被暴露。同樣,廣中和(hé)抗HIV抗體3BNC117和(hé)10-1074僅在CD4與HIV-1包膜接合以暫時(shí)暴露脆弱的CD4結合位點。因此,隻有在存在小(xiǎo)分子CD4模拟物的情況下(xià),接種HIV-1 gp120變異株的非人靈長類動物對(duì)HIV-1感染T細胞的抗體依賴性細胞毒性(ADCC)改善。gp41包膜蛋白(bái)的膜近端外(wài)部區(qū)域引發最廣泛的中和(hé)單克隆抗體(例如4E10、LN01、VRC42),但(dàn)這(zhè)些(xiē)很(hěn)少見,因爲該表位僅在融合前至融合後的轉化過程中短暫暴露。可能(néng)需要同時(shí)給藥兩種抗體才能(néng)接近某些(xiē)表位:一種抗體可使靶蛋白(bái)穩定在開(kāi)放(fàng)狀态(例如受體模拟物),另一種抗體可與敏感表位結合。
靶向可變抗原的抗體
上(shàng)述例子突顯了(le)靶向僅需要少數蛋白(bái)質就可感染細胞的病毒的易損表位所面臨的挑戰。将這(zhè)些(xiē)策略應用(yòng)于表達更多表面抗原的細菌病原體會(huì)帶來(lái)額外(wài)的挑戰,因爲在許多情況下(xià),靶點的關鍵分子并不明(míng)顯。
鑒于細菌碳水(shuǐ)化合物(脂多糖和(hé)莢膜多糖)的豐度、可及性和(hé)免疫原性,它們一直是主要靶點。事(shì)實上(shàng),使用(yòng)腦(nǎo)膜炎奈瑟氏菌血清群A膠囊的糖綴合物接種疫苗幾乎消除了(le)該血清群的臨床病例。遺憾的是,這(zhè)些(xiē)分子也(yě)具有高(gāo)度的變異型:雖然銅綠假單胞菌脂多糖疫苗在動物模型中可誘導保護性免疫,但(dàn)存在20種以上(shàng) o抗原血清型,許多有多個亞型,因此有必要開(kāi)發血清型特異性治療方法。
鑒于細菌碳水(shuǐ)化合物的多樣性和(hé)産生針對(duì)這(zhè)些(xiē)柔性分子的抗體的挑戰,保守表面蛋白(bái)可能(néng)更适合作(zuò)爲抗體靶點。鑒定出一種與大(dà)腸杆菌必需外(wài)膜輸出蛋白(bái)BamA結合的抗體,該抗體與一個細胞外(wài)環結合,從(cóng)而破壞BamA功能(néng)。抗體結合誘導細菌應激反應,破壞外(wài)膜完整性,并在亞納摩爾濃度(49)下(xià)殺死細菌。然而,由于外(wài)膜蛋白(bái)隐藏在表面碳水(shuǐ)化合物之下(xià),因此該抗體僅對(duì)具有最小(xiǎo)脂多糖結構的菌株有效。
盡管已經鑒定出成功的抗原,如腦(nǎo)膜炎奈瑟氏菌H因子(22)和(hé)肺炎鏈球菌PhtD蛋白(bái),但(dàn)這(zhè)些(xiē)報(bào)告凸顯了(le)預先選擇合适的細菌靶點的挑戰。爲了(le)替代使用(yòng)靶向未知(zhī)方法分離抗體,DiGiandomenico等從(cóng)感染患者和(hé)健康人中鑒定出與完整銅綠假單胞菌細胞結合的抗體,并對(duì)其進行調理(lǐ)吞噬細胞殺傷篩選。一組單基因敲除的銅綠假單胞菌分離株表明(míng),所有選擇的抗體均結合了(le)表面暴露的多糖Psl,該多糖在多個菌株中保守,并在多種疾病狀态下(xià)表達。抗ps1鉛抗體Cam-003結合了(le)173株銅綠假單胞菌臨床分離株中的85%,盡管親和(hé)力僅爲144 nM,但(dàn)在小(xiǎo)鼠急性緻死性肺炎模型中提供了(le)強大(dà)的保護作(zuò)用(yòng)。
病原體的适應性需要抗體靶向方法的創新。這(zhè)可以包括使用(yòng)來(lái)自(zì)多個毒株的抗原誘餌來(lái)識别針對(duì)已知(zhī)靶點的交叉反應性抗體的抗體發現(xiàn)策略,這(zhè)種方法已經識别了(le)結合不同病毒表位的一系列抗體。爲了(le)将這(zhè)些(xiē)方法擴展到(dào)更複雜(zá)的細菌病原體,靶向未知(zhī)方法以及随後對(duì)所需功能(néng)的廣泛篩查顯示出了(le)希望。
轉載說明(míng):本文(wén)圖文(wén)源自(zì) Annual Review of Chemical and Biomolecular Engineering,僅做學術分享使用(yòng);感謝(xiè)每一位作(zuò)者的辛苦付出與創作(zuò),除轉載衆多無法溯源的文(wén)章,我們均在文(wén)章中備注了(le)來(lái)源。如轉載涉及版權等問題,請(qǐng)聯系我們删除,非常感謝(xiè)!

 聯系我們
聯系我們





