新發和(hé)再發傳染病構成的威脅突出表明(míng)需要制定新的策略來(lái)克服這(zhè)些(xiē)感染。此外(wài),耐多藥微生物的出現(xiàn)促使我們需要開(kāi)發标準抗生素方案的替代策略。其中一種策略是使用(yòng)可同時(shí)發揮預防和(hé)治療作(zuò)用(yòng)的人單克隆抗體(Mab)。在過去的十年中,随着mAb在該領域的廣泛應用(yòng),包括感染性疾病在内的廣泛病理(lǐ)領域的mAb試驗迅速增加。噬菌體展示、酵母展示、mRNA展示、核糖體展示、細菌展示、哺乳動物細胞表面展示等抗體展示技術的發展,促進了(le)新型單克隆抗體的快(kuài)速發展。這(zhè)些(xiē)體外(wài)選擇技術的基本原理(lǐ)源于表型(顯示的抗體結構)和(hé)基因型(抗體基因)之間的物理(lǐ)聯系。即使有不同的展示方法,噬菌體展示仍被廣泛認爲是抗體展示的首選方式。
成功的單抗選擇過程的一般要求是存在多種可供選擇的抗體基因組合庫。這(zhè)種抗體基因的集合通常被稱爲抗體文(wén)庫。抗體文(wén)庫可以通過展示的抗體基因的來(lái)源來(lái)區(qū)分。這(zhè)包括初始(健康個體)、免疫(受感染或免疫的個體)、合成(化學合成)和(hé)半合成(天然免疫基因和(hé)化學合成基因的混合物)文(wén)庫。人類抗體文(wén)庫的開(kāi)發需要從(cóng)人類供體中獲得B細胞,由于所需樣品的特定特征,如B細胞來(lái)源,以及在研究中使用(yòng)人類生物樣品方面的嚴格規定,有時(shí)會(huì)成爲瓶頸。除人類外(wài),動物也(yě)是生成抗體文(wén)庫的B細胞的重要來(lái)源。在傳染病的背景下(xià),免疫文(wén)庫是非常有吸引力的選擇,因爲它們被設計(jì)用(yòng)來(lái)反映受感染個體或免疫動物的免疫反應,反映針對(duì)該感染的有偏見的抗體基因庫。這(zhè)隻在B細胞能(néng)夠引起對(duì)感染的免疫反應的情況下(xià)是正确的。因此,對(duì)特定感染的免疫反應的性質是免疫抗體文(wén)庫設計(jì)的關鍵,并決定了(le)文(wén)庫的效用(yòng)、質量和(hé)多功能(néng)性。然而,通過免疫球蛋白(bái)基因組合混合構建的體外(wài)免疫抗體庫庫可能(néng)不能(néng)完全反映天然抗體庫的真實性質,因爲重鏈和(hé)輕鏈的随機配對(duì)可能(néng)導緻折疊錯誤的無功能(néng)抗體克隆。在這(zhè)裏,我們從(cóng)免疫文(wén)庫的角度回顧了(le)對(duì)不同感染的免疫反應如何影響抗感染的鑒定,并改進了(le)免疫抗體文(wén)庫用(yòng)于噬菌體展示的庫表示的考慮。
免疫抗體庫
B細胞作(zuò)爲免疫系統的主要組成部分,保護我們的身體免受有害抗原的影響,在感染發生之前和(hé)之後不斷産生抗體。健康狀态下(xià)的抗體庫具有足夠的多樣性,可以産生針對(duì)新感染的應答(dá),也(yě)可以記住舊感染。B細胞的這(zhè)一主要特征是通過兩個主要機制實現(xiàn)的,即變量(V)的V(D)J重組、多樣性(D)和(hé)連接(J)基因片段和(hé)體細胞超突變(SHM)。這(zhè)包括在較小(xiǎo)程度上(shàng)增加抗體組庫多樣性的非常規次要機制,包括違反12/23重組規則的非标準重組、shm相關的基因插入和(hé)缺失、抗體的非互補決定區(qū)(non- cdr)與抗原的直接接觸、翻譯後修飾、構象異質性和(hé)使用(yòng)非蛋白(bái)輔因子。這(zhè)些(xiē)機制共同導緻抗體cdr的不同變化,形成主要抗原結合位點。導緻成熟抗體基因産生的事(shì)件也(yě)是多方面的,因爲多個可變基因的重組一開(kāi)始就提供了(le)很(hěn)大(dà)的組合多樣性,并進一步擴展爲不同的重鏈(VH)和(hé)輕鏈(VL)組合(圖1)。由于SHM和(hé)相關機制在遇到(dào)抗原時(shí)被引出,暴露于感染會(huì)影響最終産生的抗體庫,因爲抗體庫會(huì)發生偏倚,并被塑造成與入侵病原體作(zuò)戰的抗體庫。
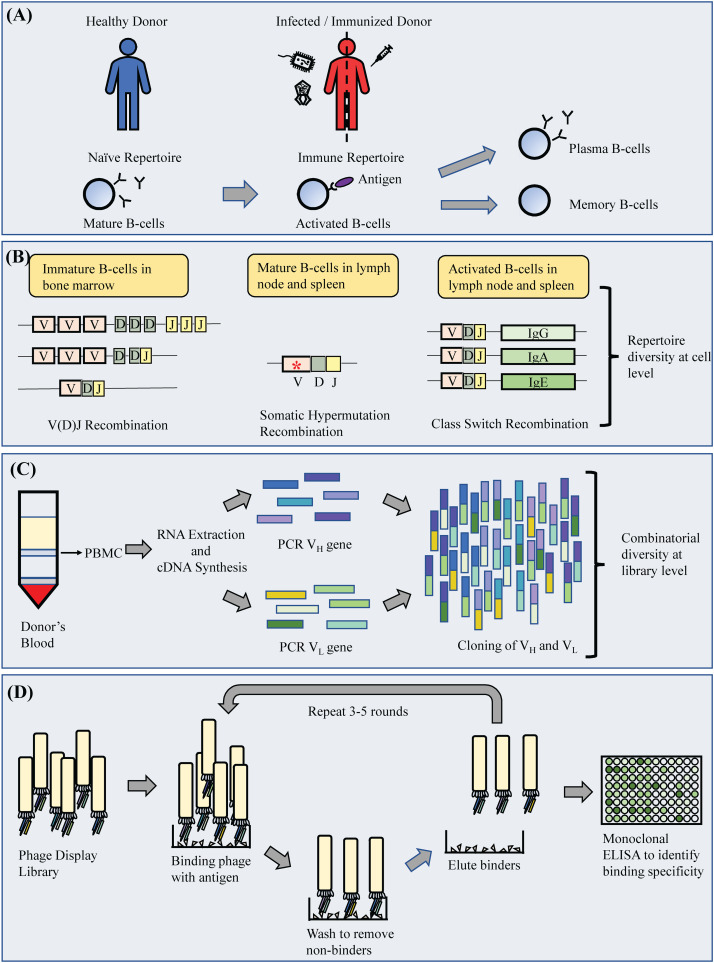
盡管免疫抗體庫在分離疾病特異性結合物方面提供了(le)更好(hǎo)的前景,但(dàn)目前的大(dà)多數噬菌體展示抗體方法主要集中在使用(yòng)初始細胞庫來(lái)制備抗傳染病的單克隆抗體,正如美(měi)國食品藥品監督管理(lǐ)局(FDA)和(hé)歐洲藥品管理(lǐ)局(EMA)批準的大(dà)多數噬菌體展示單克隆抗體。
免疫抗體庫在傳染病中的應用(yòng)
源自(zì)免疫抗體庫的抗體具有用(yòng)作(zuò)診斷試劑或治療劑的潛力。雖然從(cóng)康複患者創建的免疫文(wén)庫是治療性mAb的理(lǐ)想選擇,但(dàn)也(yě)可以從(cóng)免疫動物(如小(xiǎo)鼠、雞、美(měi)洲駝、羊駝、駱駝、綿羊、鲨魚和(hé)非人靈長類動物)中創建免疫文(wén)庫。
細菌感染
從(cóng)曆史上(shàng)看(kàn),細菌感染用(yòng)動物的抗血清治療,後來(lái)用(yòng)抗生素治療。細菌的進化導緻了(le)耐藥菌株的激增,這(zhè)削弱了(le)基于抗生素的治療策略的療效。因此,mAb被吹捧爲抗生素耐藥細菌感染的潛在替代品。一般來(lái)說,細菌毒素在增強感染方面起着重要作(zuò)用(yòng)。破傷風(fēng)類毒素免疫文(wén)庫是首批由免疫人外(wài)周B細胞庫構建的組合免疫抗體庫之一,從(cóng)中成功分離出多個mAb,但(dàn)未評估其中和(hé)潛力。
病毒感染
免疫抗體庫也(yě)被廣泛用(yòng)于發現(xiàn)針對(duì)病毒感染的中和(hé)單克隆抗體,如登革熱、埃博拉病毒病、乙型肝炎、人類免疫缺陷病毒(HIV)感染、流感、麻疹、狂犬病和(hé)呼吸道(dào)合胞病毒(RSV)。大(dà)多數商業化抗病毒單抗開(kāi)發的共同和(hé)有效策略是在感染的初始階段通過與病毒表面受體(如包膜糖蛋白(bái)(gp)、刺突蛋白(bái)和(hé)受體結合域(RBD))的抗體結合使病毒失活,從(cóng)而抑制病毒進入宿主細胞的内化。免疫抗體庫中抗體庫的多樣性也(yě)可用(yòng)于廣譜中和(hé)單克隆抗體的分離。對(duì)來(lái)自(zì)免疫抗體庫的單克隆抗體進行的研究表明(míng),單克隆抗體對(duì)來(lái)自(zì)同一家族或亞型的多種病毒的保守表位具有交叉反應性,這(zhè)一點在一項關于H5N1流感的研究中得到(dào)了(le)證明(míng),從(cóng)H5N1流感幸存者創建的組合免疫庫中分離出的300多種單克隆抗體能(néng)夠中和(hé)H1和(hé)H5亞型流感病毒。這(zhè)說明(míng)了(le)組合免疫文(wén)庫在選擇針對(duì)攜帶相似表位的密切相關抗原的抗體方面的應用(yòng)。
寄生蟲感染
由原生動物、蠕蟲和(hé)體表寄生蟲引起的寄生蟲病也(yě)是一個主要的衛生保健負擔。最常見的例子之一是引起瘧疾的蚊媒原生動物瘧原蟲。已經建立了(le)免疫文(wén)庫,用(yòng)于分離針對(duì)惡性瘧原蟲Pfs48/45配子表面蛋白(bái)和(hé)惡性瘧原蟲裂殖子表面蛋白(bái)-1 Block 2區(qū)以及其他(tā)寄生蟲如豬帶縧蟲Ts14糖蛋白(bái)和(hé)剛地弓形蟲MIC2蛋白(bái)的單克隆抗體。隻有針對(duì)惡性瘧原蟲配子細胞表面蛋白(bái)的單克隆抗體阻斷了(le)吸血後瘧原蟲在蚊子體内的發育。這(zhè)表明(míng)了(le)免疫文(wén)庫衍生抗體在阻斷寄生蟲病傳播方面的潛在用(yòng)途。随着單克隆抗體發現(xiàn)技術的成熟和(hé)更多單克隆抗體的出現(xiàn),有望爲無有效藥物治療的感染性疾病提供更經濟有效的解決方案。
免疫抗體文(wén)庫不僅能(néng)夠産生高(gāo)親和(hé)力的疾病特異性單克隆抗體,而且還具有産生針對(duì)其他(tā)靶蛋白(bái)的單克隆抗體的多樣性,使其成爲抗體噬菌體展示實驗室中初始細胞文(wén)庫不可缺少的替代品。
參考資料
[1]H.D. Marston, Monoclonal antibodies for emerging infectious diseases — borrowing from history,N. Engl. J. Med., 378 (16) (2018), pp. 1469-1472
[2]E.K. Wagner,Engineering therapeutic antibodies to combat infectious diseases,Curr. Opin. Chem. Eng., 19 (2018), pp. 131-141
[3]K.B. Hoehn,The diversity and molecular evolution of B-cell receptors during infection,Mol. Biol. Evol., 33 (5) (2016), pp. 1147-1157
[4]A. Kanyavuz,Breaking the law: unconventional strategies for antibody diversification,Nat. Rev. Immunol., 19 (6) (2019), pp. 355-368
[5]L.M. Walker, D.R. Burton,Passive immunotherapy of viral infections: ‘super-antibodies’ enter the fray,Nat. Rev. Immunol., 18 (5) (2018), pp. 297-308

 聯系我們
聯系我們





