随着針對(duì)許多細菌病原體的有效抗生素的逐漸喪失,噬菌體療法作(zuò)爲治療感染的手段引起了(le)人們的新興趣。一些(xiē)噬菌體産生抗菌蛋白(bái),導緻其宿主細胞裂解。研究人員最近确定了(le)一種“YES”複合物的結構,由噬菌體蛋白(bái)E和(hé)參與細胞壁生物合成的兩種蛋白(bái)質MraY和(hé)SlyD組成。蛋白(bái)E阻斷MraY中的底物結合位點,從(cóng)而阻斷其必需的酶活性。這(zhè)些(xiē)發現(xiàn)可能(néng)有助于更好(hǎo)地了(le)解噬菌體機制并助力噬菌體策略的開(kāi)發。
作(zuò)爲其生命周期的一部分,病毒必須從(cóng)宿主中逃逸。對(duì)于噬菌體,這(zhè)個過程需要突破細菌細胞壁和(hé)肽聚糖層。小(xiǎo)的單鏈DNA和(hé)RNA噬菌體已經進化出單基因裂解蛋白(bái),這(zhè)些(xiē)裂解蛋白(bái)會(huì)破壞肽聚糖的生物合成并觸發細胞裂解,這(zhè)是一些(xiē)抗生素也(yě)使用(yòng)的機制。其中研究得最好(hǎo)的是來(lái)自(zì)曆史上(shàng)重要的噬菌體ΦX174的蛋白(bái)質E,這(zhè)是一種91個氨基酸的蛋白(bái)質,含有保守的N端跨膜螺旋和(hé)延伸的細胞質C末端。
突變研究表明(míng),蛋白(bái)E跨膜結構域足以裂解,有功能(néng)的突變體映射到(dào)單個跨膜螺旋的一個面。在蛋白(bái)E的這(zhè)個結構域中,保守的脯氨酸表現(xiàn)出最強的表型,其中一種脯氨酸是裂解所必需的。野生型蛋白(bái)E需要組成型表達的細菌伴侶蛋白(bái)SlyD(對(duì)裂解D敏感),該蛋白(bái)包含脯氨酰異構酶結構域和(hé)伴侶結構域。之前的工(gōng)作(zuò)已經在MraY中發現(xiàn)了(le)使其對(duì)蛋白(bái)e介導的溶解産生抗性的突變體。MraY催化可溶性核苷-糖-肽和(hé)磷脂底物合成肽聚糖前體。雖然關于MraY還有很(hěn)多功能(néng)上(shàng)的問題,但(dàn)研究人員試圖了(le)解噬菌體蛋白(bái)如何特異性地抑制這(zhè)一關鍵酶,以及SlyD在這(zhè)一過程中發揮了(le)什(shén)麽作(zuò)用(yòng)。
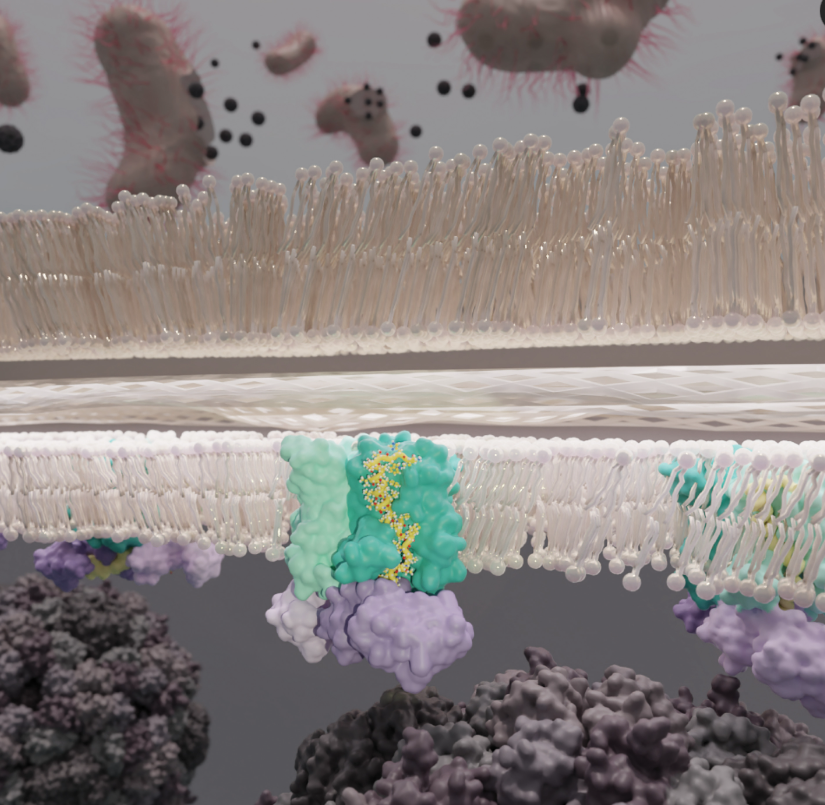
研究人員建立了(le)噬菌體蛋白(bái)E與大(dà)腸杆菌蛋白(bái)MraY和(hé)SlyD形成穩定的複合體,命名爲YES複合體。在洗滌劑中溶解後,通過單粒子電子冷凍顯微鏡确定了(le)YES複合物的結構——MraY二聚體采用(yòng)背靠背的方向,暴露在膜上(shàng)的活性位點彼此背對(duì)。兩個sld分子可以放(fàng)入細胞質側的密度中。兩條MraY和(hé)sld鏈由兩個蛋白(bái)E分子連接。蛋白(bái)E的跨膜螺旋在MraY上(shàng)占據一個凹槽,對(duì)應于脂質底物的假定結合位點。在細胞質表面,蛋白(bái)E的跨膜結構域發生彎曲,穿過活性位點,然後形成一個α-螺旋,延伸到(dào)sld的伴侶結構域。蛋白(bái)質E的c末端繼續通過第二個sld中的一個肽結合槽并進入脯氨酰異構酶活性位點。其結果是蛋白(bái)E通過阻斷脂質進入活性部位來(lái)抑制MraY。之前的蛋白(bái)E突變表型可以通過包含必需的脯氨酸的結構來(lái)解釋,脯氨酸允許跨膜螺旋發生扭結。對(duì)于MraY,我們可以解析包括TM1和(hé)TM2之間的保守環在内的整個鏈。我們證明(míng)了(le)MraY的N端與TM2形成一個α-螺旋堆疊,并鑒定了(le)蛋白(bái)質表面有序的脂質。最後,我們提供了(le)證據表明(míng)SlyD的作(zuò)用(yòng)是穩定複合物。
蛋白(bái)E通過阻斷MraY活性位點與SlyD形成穩定複合物直接抑制MraY。這(zhè)一結構解決了(le)模型噬菌體ΦX174如何殺死細菌并逃逸細胞的關鍵問題。在ΦX174基因組中,編碼蛋白(bái)質E的基因在進化上(shàng)受到(dào)其嵌入的基因D的限制。YES複合物爲蛋白(bái)E的理(lǐ)性設計(jì)提供了(le)一條超出基因D限制的途徑。單基因裂解蛋白(bái),如蛋白(bái)E,爲開(kāi)發抗菌療法提供了(le)有用(yòng)的模型。
原文(wén):
The historically important phage ΦX174 kills its host bacteria by encoding a 91-residue protein antibiotic called protein E. Using single-particle electron cryo–microscopy, we demonstrate that protein E bridges two bacterial proteins to form the transmembrane YES complex [MraY, protein E, sensitivity to lysis D (SlyD)]. Protein E inhibits peptidoglycan biosynthesis by obstructing the MraY active site leading to loss of lipid I production. We experimentally validate this result for two different viral species, providing a clear model for bacterial lysis and unifying previous experimental data. Additionally, we characterize the Escherichia coli MraY structure—revealing features of this essential enzyme—and the structure of the chaperone SlyD bound to a protein. Our structures provide insights into the mechanism of phage-mediated lysis and for structure-based design of phage therapeutics.

 聯系我們
聯系我們





