抗CD20單克隆抗體(如利妥昔單抗、ofatumumab或obinutuzumab)的引入改善了(le)B細胞惡性腫瘤的治療,盡管CD20的确切生理(lǐ)作(zuò)用(yòng)和(hé)調節尚不清楚。此外(wài),CD20 表達在不同的 B 細胞惡性腫瘤、具有相同惡性腫瘤的患者之間,甚至在個體患者的克隆内亞群之間都存在很(hěn)大(dà)差異。
1997年,美(měi)國食品藥品監督管理(lǐ)局批準了(le)抗CD20抗體利妥昔單抗,這(zhè)是B細胞惡性腫瘤治療的一個概念突破。在“成熟”B細胞白(bái)血病和(hé)淋巴瘤(如慢性淋巴細胞白(bái)血病(CLL)、濾泡性淋巴瘤和(hé)彌漫性大(dà)B細胞淋巴瘤(DLBCL))的化療基礎上(shàng)加用(yòng)利妥昔單抗可改善無進展生存期和(hé)總生存率,這(zhè)證明(míng)了(le)單克隆抗體可用(yòng)于癌症治療。
基于利妥昔單抗的成功,一系列新的工(gōng)程抗CD20單克隆抗體被進一步開(kāi)發。抗CD20單克隆抗體可能(néng)通過多種機制起作(zuò)用(yòng),包括補體依賴性細胞毒性(CDC),補體依賴性細胞毒性,抗體依賴性細胞毒性(ADCC),抗體依賴性細胞吞噬作(zuò)用(yòng)和(hé)直接細胞凋亡誘導。所有這(zhè)些(xiē)機制都在體外(wài)和(hé)/或動物模型中觀察到(dào),并且可能(néng)在體内也(yě)作(zuò)用(yòng)于患者,但(dàn)它們對(duì)不同抗CD20單克隆抗體的臨床效果的相對(duì)貢獻仍然存在争議(yì)。
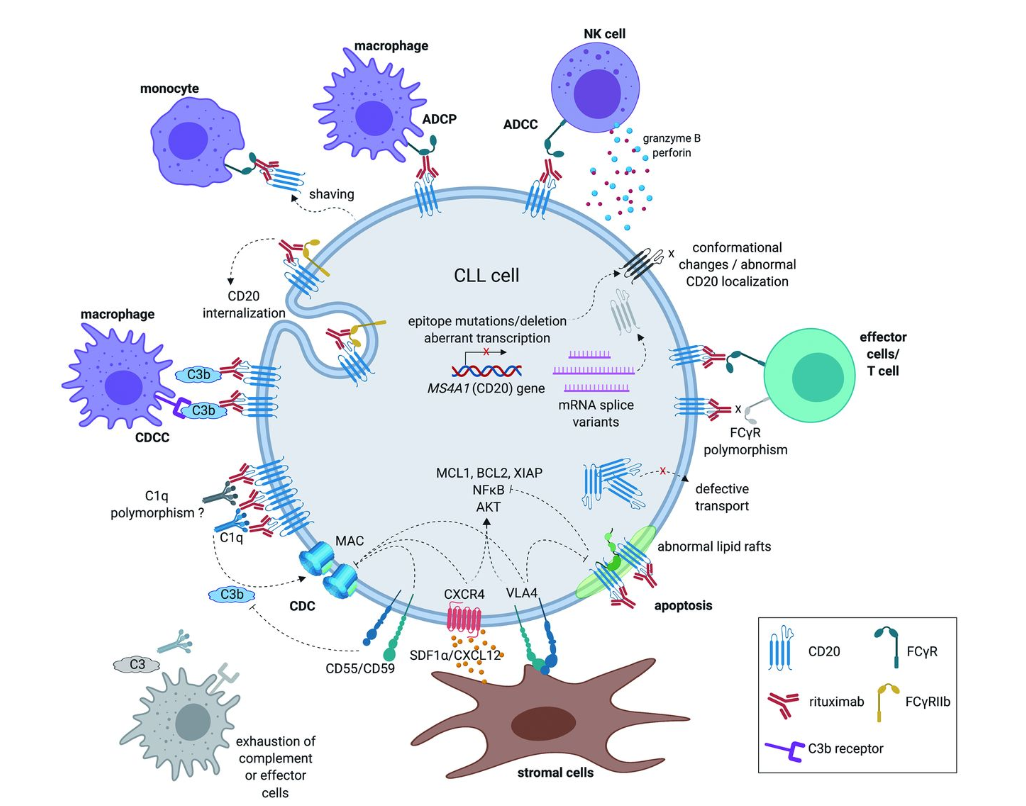
抗CD20單克隆抗體的已知(zhī)作(zuò)用(yòng)機制以及影響惡性B細胞抗CD20耐藥性的潛在因素
CD20基因和(hé)蛋白(bái)質結構
CD20是一種表達于正常和(hé)惡性B淋巴細胞表面的33 ~ 37 kDa的非糖基化蛋白(bái),屬于MS4A(跨膜4域家族a)蛋白(bái)家族。迄今爲止,已鑒定出18個MS4A家族成員,除了(le)MS4A1(編碼CD20)外(wài),還有高(gāo)親和(hé)力的免疫球蛋白(bái)E受體β亞基(MS4A2/FcεRIβ)或HtM4基因(MS4A3)。MS4A是一種跨膜分子,預測它們具有相似的多肽序列和(hé)整體拓撲結構。包括MS4A1在内的大(dà)多數MS4A基因定位于人類染色體11q12上(shàng)的一個基因簇(小(xiǎo)鼠染色體19),而來(lái)自(zì)一個密切相關的TMEM176基因家族的兩個成員定位于染色體7q36.1區(qū)域。
MS4A1基因長16 kb,包含8個外(wài)顯子,并注釋了(le)幾種不同的CD20 mRNA轉錄本。主要的CD20 mRNA變異體長2.8 kb,使用(yòng)全部8個外(wài)顯子,而第二常見的形式短263個堿基,因爲它跳過外(wài)顯子II。一個較小(xiǎo)的3.5 kb mRNA由上(shàng)遊區(qū)域的外(wài)顯子剪接到(dào)位于外(wài)顯子i的内部3 '剪接位點。然而,由于翻譯起始密碼子位于外(wài)顯子III,所有三個轉錄本都被翻譯成相同的全長CD20蛋白(bái)。此外(wài),在惡性B細胞中還發現(xiàn)了(le)其他(tā)的替代轉錄本,其中一些(xiē)編碼CD20蛋白(bái)的截短形式,導緻抗CD20單克隆抗體的結合受損。
CD20蛋白(bái)包含4個疏水(shuǐ)跨膜結構域,1個胞内結構域和(hé)2個胞外(wài)結構域(大(dà)、小(xiǎo)環),N端和(hé)C端均位于胞質内。CD20有三種不同的磷酸化形式(33,35和(hé)37 kDa),且增殖期惡性B細胞的CD20磷酸化水(shuǐ)平高(gāo)于靜止期B細胞。正常情況下(xià),CD20不形成異聚體,而是以同型二聚體和(hé)同型四聚體的形式存在于細胞表面,與其他(tā)細胞表面和(hé)細胞質蛋白(bái)結合,參與信号轉導。四跨膜蛋白(bái)往往與膜微域内的多種其他(tā)蛋白(bái)結合(圖2)。能(néng)量轉移實驗表明(míng),CD20與其他(tā)四跨膜分子(如CD53、CD81和(hé)CD82)靠近,形成超分子複合物(圖2)。已知(zhī)CD20還與主要組織相容性複合體ⅱ類(MHCII)、CD40分子、BCR和(hé)C末端src激酶結合蛋白(bái)(CBP)物理(lǐ)偶聯,而CBP與src激酶(如LYN、FYN和(hé)CBP)相互作(zuò)用(yòng)。除了(le)跨膜形式的CD20外(wài),CLL患者血漿中還報(bào)告了(le)循環CD20;然而,這(zhè)很(hěn)可能(néng)是一個更大(dà)的蛋白(bái)複合物的一部分,或者是源于細胞破裂的細胞膜片段。
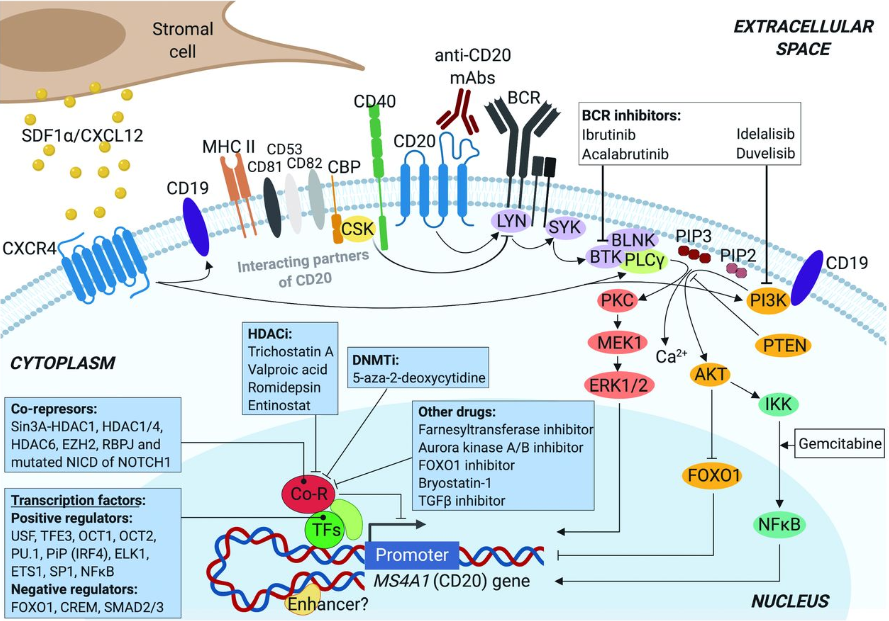
CD20在細胞膜上(shàng)的相互作(zuò)用(yòng)以及惡性B細胞中CD20基因(MS4A1)調控機制
CD20是一般B細胞标志物,由大(dà)多數B細胞從(cóng)晚期前B淋巴細胞開(kāi)始表達(它不由前B淋巴細胞表達),其表達在終末分化的漿母細胞和(hé)漿細胞中丢失。最近,已經描述了(le)具有免疫調節和(hé)促炎活性的CD20 T細胞亞群;然而,其臨床相關性仍有待确定。在B細胞惡性腫瘤中,CD20表達的水(shuǐ)平因特異性腫瘤而異,通常在CLL患者中觀察到(dào)最低(dī)的CD20表達,在DLBCL和(hé)毛細胞白(bái)血病細胞上(shàng)觀察到(dào)最高(gāo)的CD20細胞表面表達。在CLL中,注意到(dào)具有免疫球蛋白(bái)基因(IGHV)突變可變區(qū)域的疾病亞型中的CD20表達也(yě)相對(duì)高(gāo)于具有未突變IGHV的亞型。
利妥昔單抗是目前應用(yòng)最廣泛、最有效的治療性單克隆抗體之一,但(dàn)惡性B細胞可能(néng)對(duì)利妥昔單抗産生相對(duì)耐藥。惡性B細胞對(duì)抗CD20單克隆抗體耐藥的機制包括調節蛋白(bái)CD55、CD59或H因子表達增加導緻的CDC活性不足,在有特異性FcγRIII多态性的病例中,ADCC效果較差,細胞毒性機制耗竭(如補體/效應細胞),補體成分C1qA的多态性,或者脂筏的組成和(hé)定位異常,因此利妥昔單抗誘導的凋亡受損(圖1)56然而,抗CD20單克隆抗體耐藥的最直接和(hé)最常見原因之一是CD20表達減少,這(zhè)可能(néng)是由于(逆)轉錄、轉錄後或翻譯後機制(包括CD20蛋白(bái)轉運至細胞表面)的調節。
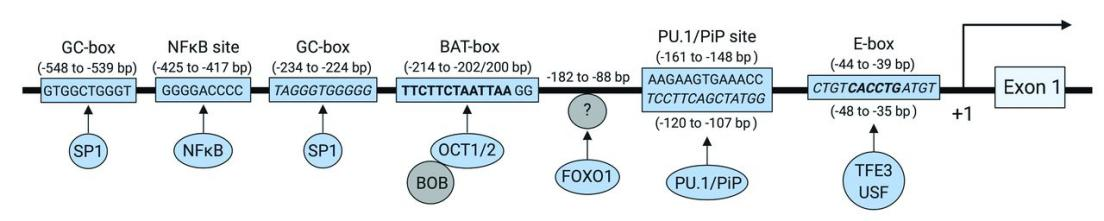
具有轉錄因子結合位點的MS4A1啓動子近端區(qū)域的示意圖
十多年來(lái),科學家和(hé)臨床醫(yī)生已經習慣了(le)将利妥昔單抗添加到(dào)其他(tā)療法中可提高(gāo)B細胞惡性腫瘤治療效果的經驗經驗。這(zhè)也(yě)促使人們研究在B細胞表面誘導更高(gāo)CD20水(shuǐ)平的策略,以潛在地使惡性細胞對(duì)抗CD20單克隆抗體敏感。CD20水(shuǐ)平似乎在利妥昔單抗誘導的CDC中起重要作(zuò)用(yòng),但(dàn)似乎與ADCC的相關性較低(dī)。
盡管CD20被認爲是理(lǐ)想的治療靶點,并且基于利妥昔單抗的免疫療法已成爲大(dà)多數B細胞惡性腫瘤的标準治療,但(dàn)尚不清楚CD20的所有功能(néng)是什(shén)麽,以及其表達如何調節。主要原因是B細胞惡性腫瘤患者的異質性大(dà),缺乏具有明(míng)顯表型的小(xiǎo)鼠模型,這(zhè)使得CD20體内分析更加困難。充分了(le)解CD20調控的複雜(zá)性、其生理(lǐ)功能(néng)和(hé)抗CD20單克隆抗體的确切作(zuò)用(yòng)機制,對(duì)于開(kāi)發新的修飾抗CD20單克隆抗體及其治療組合至關重要,這(zhè)些(xiē)組合将産生更好(hǎo)的臨床療效和(hé)/或更少的毒性。最近,CD20在微環境相互作(zuò)用(yòng)中的可能(néng)作(zuò)用(yòng)被觀察到(dào)CD20在免疫生态位的背景下(xià)上(shàng)調所強調。這(zhè)可能(néng)具有生理(lǐ)重要性,特别是對(duì)于BCR信号傳導;然而,目前尚不清楚這(zhè)是否與CD20作(zuò)爲BCR觸發的鈣通量調節劑的假定功能(néng)有關,或者在T細胞相互作(zuò)用(yòng)或某些(xiē)附加功能(néng)中的任何潛在作(zuò)用(yòng)有關。需要進一步研究CD20的生理(lǐ)功能(néng),包括鑒定與CD20相互作(zuò)用(yòng)的分子,因爲這(zhè)對(duì)合理(lǐ)的治療組合和(hé)策略的發展具有影響。

 聯系我們
聯系我們





