單克隆抗體技術是現(xiàn)代生命科學研究的重要工(gōng)具,其在蛋白(bái)質的結構與功能(néng)研究、疾病診斷、藥效學及臨床應用(yòng)等方面有着不可或缺的作(zuò)用(yòng)。近年來(lái),随着分子生物學和(hé)細胞生物學的發展,單個B細胞抗體制備技術開(kāi)始興起,并逐漸得到(dào)廣泛應用(yòng)。單個B細胞抗體技術制備的單克隆抗體所具有的全人源性、自(zì)身高(gāo)度特異性和(hé)均一性的特點在治療病原微生物感染、腫瘤、自(zì)身免疫性疾病和(hé)器官移植等方面顯出了(le)獨特的優勢和(hé)良好(hǎo)的應用(yòng)前景。
Xten™MabSingleB兔單克隆抗體開(kāi)發以單個B細胞爲起始點,利用(yòng)每個B細胞隻産生一種特異性抗體的特性,直接從(cóng)免疫的兔子中通過随機分離和(hé)抗原特異性分離兩種方式從(cóng)外(wài)周血或淋巴組織中分離單B細胞,從(cóng)單個B細胞中擴增出抗體基因,進而獲得抗原特異性抗體。該技術所制備的抗體具有高(gāo)通量、高(gāo)效率、高(gāo)穩定性、高(gāo)特異性等優點,保留了(le)豐富的基因多樣性和(hé)輕重鏈可變區(qū)的天然配對(duì),應用(yòng)前景廣泛,是最高(gāo)效的抗體篩選方法之一。特别是在快(kuài)速應對(duì)病原微生物傳染病的抗體開(kāi)發上(shàng)有着巨大(dà)優勢。基于單個B細胞技術的Xten™MabSingleB兔單克隆抗體開(kāi)發有三個主要流程,鑒定和(hé)分離單個B細胞;擴增和(hé)克隆抗體基因;表達、篩選和(hé)鑒定抗原特異性抗體。
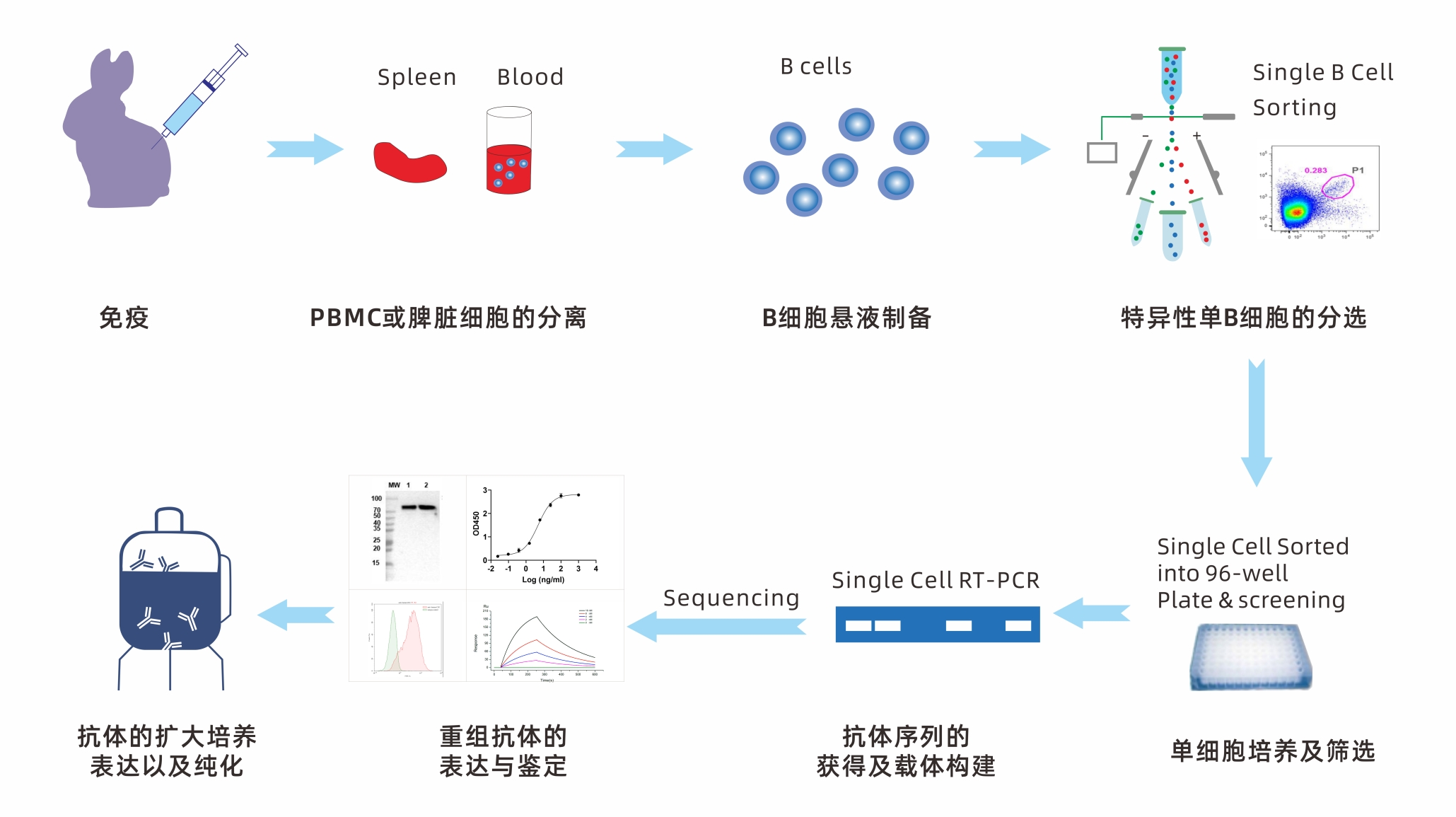
鑒定和(hé)分離單個B細胞
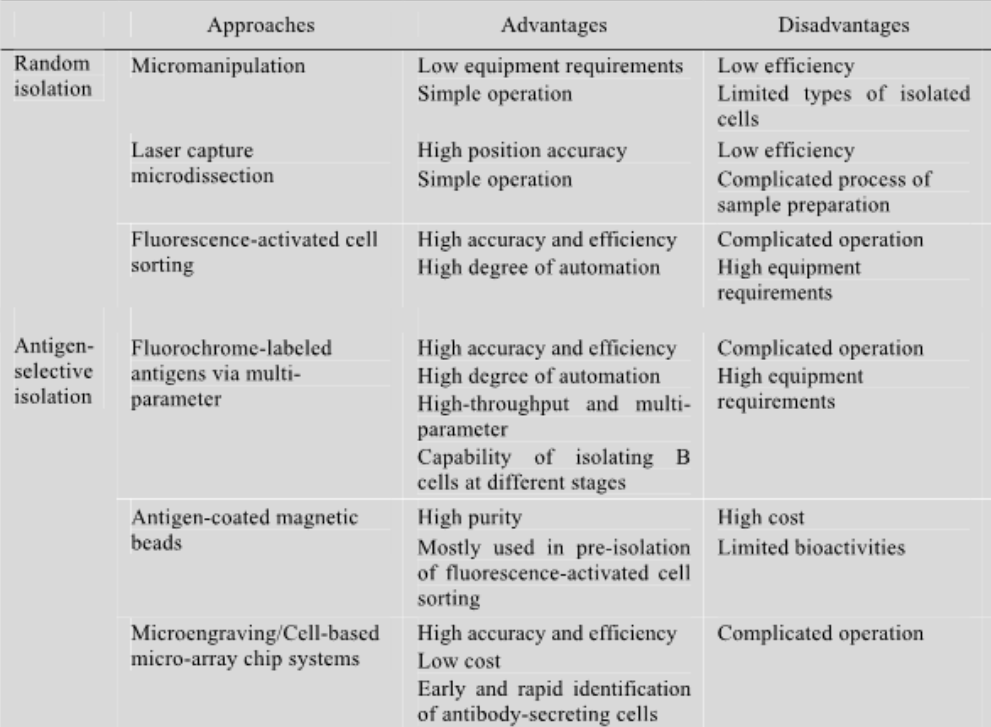
目前普遍運用(yòng)于抗原特異性單個B細胞分離的方法包括:熒光标記抗原多參數細胞分選法
(Fluorochrome-labeledantigensviamultiparameter,FACS)、抗原标記磁珠分選法(Antigencoatedmagneticbeads)、微雕法(Microengraving)以及細胞微陣列芯片法(Cell-basedmicro-arraychipsystems)。
熒光标記抗原多參數細胞分選法與熒光激活細胞分選法類似,二者差異在于前者在加入用(yòng)于标記B細胞表面抗原的熒光抗體之外(wài),還需加入熒光标記的目标抗原用(yòng)來(lái)結合B細胞表面的膜抗體,以分選目标抗原特異性的B細胞。它可以高(gāo)速分析上(shàng)萬個細胞,并能(néng)同時(shí)從(cóng)一個細胞中測得多個參數,此技術不僅提高(gāo)分離細胞的純度,而且可以得到(dào)更多的細胞信息,分選各個時(shí)期的B細胞用(yòng)于不同的研究方向。該方法具有速度快(kuài)、精度高(gāo)、自(zì)動化程度高(gāo)等優點,已成爲當代最先進的細胞定量分析分選技術。
抗原标記磁珠分選法基本原理(lǐ)是基于細胞表面目标抗原特異性抗體能(néng)與連接有磁珠的目标抗原相結合,在外(wài)加磁場中,通過目标抗原與磁珠相連的細胞被吸附而滞留在磁場中,無該種表面特異性抗體的細胞由于不能(néng)與連接着磁珠的目标抗原結合而沒有磁性,不在磁場中停留,從(cóng)而使細胞得以分離。這(zhè)種方法可以在幾分鐘(zhōng)内從(cóng)複雜(zá)的細胞混合物中分離出高(gāo)純度的細胞,在流式分選單細胞前可用(yòng)磁珠分選法進行預分離,但(dàn)是由于磁珠影響細胞生物活性因而不利于分離後培養與操作(zuò)。
微雕法基于軟光刻(Softlithographic)微陣列芯片識别、恢複和(hé)克隆産生抗原特異性抗體的B細胞,刺激多克隆B細胞産生抗體并将其逐個置于芯片孔内,将該芯片轉印至相應的蛋白(bái)芯片後,即可用(yòng)熒光标記的目标抗原識别特異性抗體,進而顯微操作(zuò)将檢測到(dào)的分泌目标抗原特異性抗體B細胞轉移到(dào)細胞培養皿中進行後續克隆操作(zuò)。
微陣列芯片法同微雕法具有高(gāo)通量(每個芯片分選細胞量高(gāo)達10萬個細胞)、快(kuài)速、成本低(dī)、可直接從(cóng)多克隆B細胞中分選并鑒定抗體分泌B細胞等優點。酶聯免疫斑點微陣列芯片法(Immunospotarrayassayonachip,ISAAC)是微陣列芯片法的延伸和(hé)補充,該方法用(yòng)包被于芯片表面的抗免疫球蛋白(bái)抗體來(lái)代替微雕法轉印蛋白(bái)芯片的過程,抗免疫球蛋白(bái)抗體能(néng)夠快(kuài)速捕捉抗體分泌B細胞分泌的抗體,進而用(yòng)生物素标記的目标抗原識别特異性抗體,從(cóng)而達到(dào)篩選并分離特異性抗體分泌B細胞的目的。ISAAC法較微雕法另一改進在于,前者能(néng)在同一塊芯片上(shàng)篩選針對(duì)多種不同目标抗原的特異性抗體,簡化了(le)實驗過程且更加高(gāo)效,是目前前景非常廣闊的分選B細胞方法。
擴增和(hé)克隆抗體基因
經典克隆未知(zhī)抗體基因的方法(如cDNA文(wén)庫篩選等)有着共同的缺點——操作(zuò)繁瑣、周期較長、工(gōng)作(zuò)量大(dà)。近些(xiē)年随着PCR技術的快(kuài)速興起和(hé)成熟,單個B細胞抗體基因的擴增和(hé)克隆也(yě)随之發展。
細胞分選時(shí),通常需将單個B細胞分至内含适量細胞裂解液、RNA酶抑制劑和(hé)PCR反應試劑的适當容器中,如96孔闆。由于單個細胞内RNA含量少,适當的容器可以方便大(dà)批量操作(zuò)防止樣品損失或交叉污染。另外(wài),不同類型B細胞抗體分泌能(néng)力差異明(míng)顯,如抗體分泌B細胞中抗體基因轉錄本含量遠高(gāo)于記憶B細胞,因此從(cóng)抗體分泌B細胞中更容易擴增得到(dào)抗體基因。
通常從(cóng)單個B細胞中擴增未知(zhī)抗體基因,需使用(yòng)合适的引物進行巢式或半巢式逆轉錄PCR(Nestedorsemi-nestedRT-PCR),該過程要求引物具有通用(yòng)性、靈敏性、特異性,能(néng)避免非特異性擴增又能(néng)擴增出完整的抗體基因序列,因此合理(lǐ)設計(jì)引物序列至關重要。通常針對(duì)抗體重鏈輕鏈可變區(qū)不同前導序列設計(jì)前向引物的混合物,反向引物特異性互補于抗體恒定區(qū)。根據實驗目的,如果分離和(hé)擴增不同同種型的抗體,反向弓物則是特異性互補于各種同種型抗體恒定區(qū)的混合物。除此之外(wài),爲方便重疊延伸PCR重組和(hé)酶切克隆抗體重鏈輕鏈可變區(qū)基因,前向引物5端和(hé)反向引物3端需要包含限制性内切酶位點。
表達、篩選和(hé)鑒定抗原特異性抗體
鑒定抗體的抗原特異性和(hé)生物活性前需将攜帶有抗體基因的表達載體在相應系統中表達,最簡單常用(yòng)的是原核表達系統,如Escherichiacoli,相較而言,真核表達系統尤其是哺乳動物細胞表達系統更有利于抗體的加工(gōng)修飾,其産物的生物活性可靠性更高(gāo),常用(yòng)的有HEK293和(hé)CHO等細胞系。通過親和(hé)層析和(hé)離子交換層析純化到(dào)的抗體,可通過SDS-PAGE,Westernblotting,ELISA等常規方法篩選和(hé)鑒定抗體,也(yě)可通過免疫沉澱(Immunoprecipitation)、空(kōng)斑法(Plaqueassay)、空(kōng)斑減少中和(hé)測定法(PRNT50assay)、流式分析法(FACSanalysis)、活細胞成像測定法(Livecellimagingassays)、體内藥物活性測定法等方法進一步測定抗體與抗原的特異性、親和(hé)力以及中和(hé)活性保護活性等生物學特性。
在過去的40年裏,随着單克隆抗體在各個領域的研究和(hé)應用(yòng)日趨廣泛。而近10年來(lái),随着基于單細胞的抗體制備相關技術的開(kāi)發和(hé)完善,單個B淋巴細胞抗體制備技術已逐漸成爲單克隆抗體制備的主要技術。單個B淋巴細胞抗體制備技術作(zuò)爲未來(lái)單克隆抗體制備的主流技術,各階段的方法和(hé)環節都存在着極大(dà)的進展空(kōng)間,所制備的單克隆抗體也(yě)具有無限的開(kāi)發和(hé)應用(yòng)前景。
參考文(wén)獻
ChiXY,YuCM,ChenW.SingleBcellmonoclonalantibodytechnologiesandapplications.ChinJBiotech,2012,28(6):651−660.

 聯系我們
聯系我們





