大(dà)腸杆菌表達體系因其表達量高(gāo)、周期短、成本低(dī)等諸多優勢特征而被廣泛用(yòng)作(zuò)重組異源蛋白(bái)質的表達宿主。據統計(jì)超過30%的重組蛋白(bái)質藥物和(hé)50%重組蛋白(bái)質的制備是使用(yòng)大(dà)腸杆菌作(zuò)爲表達宿主。蛋白(bái)質錯誤折疊或未折疊以及包涵體形成是大(dà)腸杆菌表達體系更廣泛應用(yòng)的主要阻礙。因此,重組蛋白(bái)質在大(dà)腸杆菌體系中可溶性表達策略探索意義重大(dà)。
盡管大(dà)腸杆菌表達體系有許多優點,但(dàn)是在實際應用(yòng)中也(yě)仍然存在一些(xiē)不足之處,主要包括:(1)缺乏翻譯後修飾。相較于真核表達體系,原核表達系統最大(dà)的局限性之一在于其缺乏類似于真核生物翻譯後修飾的能(néng)力,如糖基化修飾、二硫鍵氧化形成等。這(zhè)些(xiē)修飾與重組蛋白(bái)質的可溶性、穩定性及生物活性密切有關。(2)無輔助蛋白(bái)質折疊機制。原核表達體系缺乏輔助蛋白(bái)質折疊機制,重組蛋白(bái)質在原核表達體系表達過程中通常以一種自(zì)發折疊的方式形成特定結構,對(duì)于部分結構複雜(zá)、疏水(shuǐ)性強的蛋白(bái)質易于導緻錯誤折疊,最終形成無活性的包涵體(IBs)。據估計(jì),大(dà)約隻有30%異源蛋白(bái)質可以在大(dà)腸杆菌中以可溶性形式表達,其餘以包涵體的不溶性聚集物表達,或在細胞提取物中無法檢測到(dào),是蛋白(bái)質生産和(hé)純化過程中不可忽視(shì)的瓶頸,所以通過優化表達策略,改善異源蛋白(bái)質在原核表達體系中的可溶性表達也(yě)是目前研究的焦點。
那麽,重組蛋白(bái)質在大(dà)腸杆菌中通過哪些(xiē)途徑形成包涵體的呢(ne)?
自(zì)身氨基酸組成:重組蛋白(bái)質氨基酸組成中含硫氨基酸及脯氨酸的數量和(hé)比例能(néng)夠顯著影響重組蛋白(bái)質在大(dà)腸杆菌中的表達形式,含量越高(gāo),重組蛋白(bái)質更容易形成包涵體。
親疏水(shuǐ)性強弱:從(cóng)本質上(shàng)講,蛋白(bái)質的折疊過程在一定程度上(shàng)是由疏水(shuǐ)相互作(zuò)用(yòng)驅動的,同時(shí)蛋白(bái)質的聚集過程極大(dà)程度是分子間疏水(shuǐ)作(zuò)用(yòng)的結果。蛋白(bái)質自(zì)身疏水(shuǐ)性越強,分子間更容易因疏水(shuǐ)作(zuò)用(yòng)引發聚集,使蛋白(bái)質錯誤折疊的概率越大(dà)。
蛋白(bái)質合成速度:與真核表達系統不同,大(dà)腸杆菌的轉錄和(hé)翻譯是快(kuài)速且緊密耦合的,而快(kuài)速的蛋白(bái)質合成速度對(duì)具有複雜(zá)結構蛋白(bái)質的折疊卻是緻命的。由于許多真核生物蛋白(bái)質需要更長時(shí)間和(hé)/或折疊伴侶的幫助才能(néng)折疊成它們的天然狀态,蛋白(bái)質合成速率提高(gāo)一方面通常會(huì)導緻沒有足夠時(shí)間進行正确的結構折疊,另一方面蛋白(bái)質過快(kuài)合成使重組蛋白(bái)質折疊前體快(kuài)速積累緻使缺乏足夠的折疊空(kōng)間極大(dà)程度上(shàng)增加了(le)重組蛋白(bái)質之間的相互作(zuò)用(yòng),形成蛋白(bái)質聚核,促使并加速更多蛋白(bái)質聚集,聚集部分折疊、未折疊或錯誤折疊的不溶性蛋白(bái)質。
重組蛋白(bái)質分子大(dà)小(xiǎo)及結構複雜(zá)程度:大(dà)腸杆菌的平均蛋白(bái)質長度爲317個殘基,而人類的平均蛋白(bái)質長度爲510個殘基。重組蛋白(bái)質分子越大(dà),結構往往越複雜(zá),其所涉及的結構域通常越多,在蛋白(bái)質折疊過程中需要克服的分子勢能(néng)壁壘就越多,其折疊成爲準确結構的概率就越低(dī)。因此分子結構更複雜(zá)、尺寸更大(dà)的蛋白(bái)質在大(dà)腸杆菌系中的表達常伴随着因未能(néng)及時(shí)正确折疊或本身疏水(shuǐ)性結構異常暴露而聚集形成包涵體的風(fēng)險就會(huì)越高(gāo)。
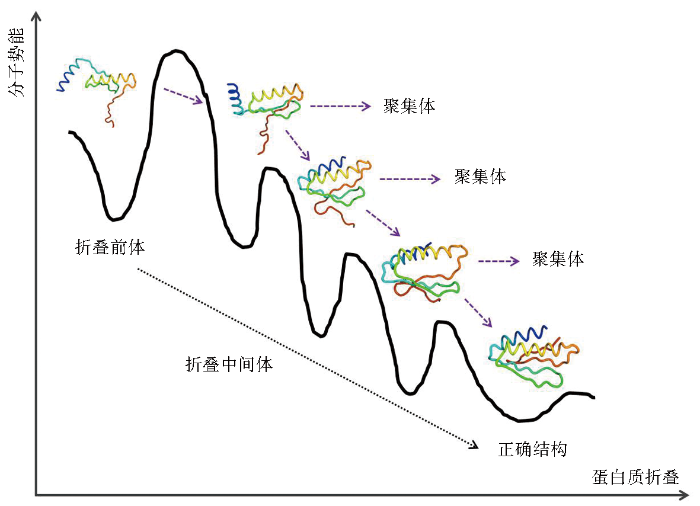
結構折疊難易程度:重組蛋白(bái)質中高(gāo)級結構類型,特别是二級結構的組成比例能(néng)夠顯著影響蛋白(bái)質的折疊速度。有研究表明(míng)α螺旋結構的折疊速度相比于β發夾結構的折疊速度快(kuài)近30倍。
二硫鍵形成與否及數量:蛋白(bái)質中的二硫鍵由兩個半胱氨酸殘基的硫原子共價連接形成,對(duì)蛋白(bái)質正确折疊、結構剛性、熱力學穩定性和(hé)生物活性至關重要。在大(dà)腸杆菌中表達含有二硫鍵的重組蛋白(bái)質,往往容易因爲其天然剛性結構難以形成而導緻重組蛋白(bái)質間互相交聯在一起,形成不溶性的無活性聚集體,這(zhè)種情況即使重組蛋白(bái)質分泌至周質中,通常也(yě)難以氧化形成正确的空(kōng)間結構,需要借助二硫鍵氧化酶或分子伴侶才能(néng)得以完成。
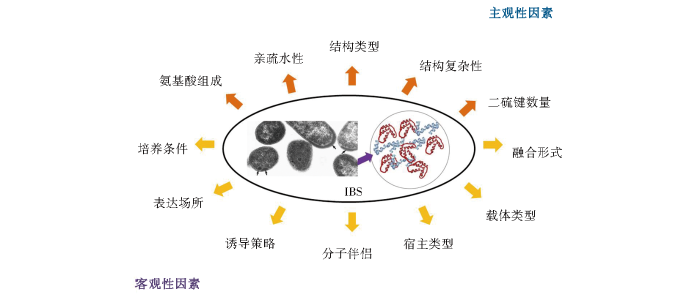
可溶性和(hé)功能(néng)性蛋白(bái)質的制備獲取是生物工(gōng)業應用(yòng)的主要目标之一,自(zì)然途徑難以獲得令人滿意的産量,通過原核表達體系制備高(gāo)效、低(dī)成本的功能(néng)性重組蛋白(bái)質成爲越來(lái)越廣泛的選擇。影響重組蛋白(bái)質在大(dà)腸杆菌體系中表達形式及表達水(shuǐ)平的因素很(hěn)多,可分爲主觀性因素和(hé)客觀性因素。主觀性因素包括蛋白(bái)質自(zì)身結構、氨基酸組成、親疏水(shuǐ)性及二硫鍵數量等,客觀性因素包括表達場所、分子伴侶(融合/非融合)、宿主類型、誘導策略、載體類型等。改善或提高(gāo)重組蛋白(bái)質在大(dà)腸杆菌體系中可溶性表達的策略主要針對(duì)以上(shàng)主客觀因素進行優化。
密碼子偏好(hǎo)性優化:參與蛋白(bái)質翻譯過程中氨基酸識别與轉運的密碼子組成具有簡并性和(hé)物種偏好(hǎo)性。密碼子偏好(hǎo)性對(duì)重組蛋白(bái)質在大(dà)腸杆菌表達體系中的表達有着直接影響,蛋白(bái)質的正确折疊依賴于基因的順暢表達,如含有大(dà)量單個或少量串列稀有密碼子(包括AGA、AGG、AUA、CCG、CCT、CTC、CGA和(hé)GTC等)的目的基因在大(dà)腸杆菌中更容易出現(xiàn)翻譯限速,甚至停滞的現(xiàn)象,導緻蛋白(bái)質折疊錯誤。因此,重組蛋白(bái)質目的基因密碼子的偏好(hǎo)性優化對(duì)提高(gāo)重組蛋白(bái)質在大(dà)腸杆菌表達體系中的高(gāo)水(shuǐ)平表達具有重要意義。
重組蛋白(bái)質誘導表達溫度優化:溫度對(duì)大(dà)腸杆菌生長、質粒穩定性、重組蛋白(bái)質表達速度及蛋白(bái)質折疊效率等有顯著影響。大(dà)腸杆菌的最佳培養溫度一般爲37℃,此溫度可能(néng)并不總是有利于目的基因在大(dà)腸杆菌中表達。在較低(dī)溫度下(xià),細菌生命代謝(xiè)速度減慢,降低(dī)轉錄、翻譯速度,較慢的翻譯速率有利于蛋白(bái)質正确折疊,同時(shí)溫度降低(dī)時(shí)聚集作(zuò)用(yòng)也(yě)得以減弱,有利于蛋白(bái)質折疊和(hé)提高(gāo)重組蛋白(bái)質可溶性表達比例。
表達載體選擇與優化:表達載體通常包括複制子、篩選标記基因、啓動子及轉錄終止子等元件,大(dà)腸杆菌的常用(yòng)表達載體包括pET系列、pCold系列、pBV系列和(hé)pGEX系列等。不同載體之間包含的元件類型和(hé)數量具有明(míng)顯差異。載體的啓動子類型對(duì)目的基因表達水(shuǐ)平和(hé)表達方式(可溶或不可溶)的影響非常顯著。常見大(dà)腸杆菌表達體系的啓動子類型包括來(lái)源于細菌的lac、tac、trp、araBAD啓動子,以及來(lái)源于噬菌體的T7、T5、SP6啓動子。pET表達載體因其具有T7強啓動子而獲得較高(gāo)表達量,是最常使用(yòng)的啓動子類型。
誘導策略及優化:異丙基β-d-1-硫代吡喃半乳糖苷(IPTG)是原核表達體系最常用(yòng)的重組蛋白(bái)質表達誘導劑之一。通過調節IPTG濃度來(lái)調控重組蛋白(bái)質的表達速度,促進蛋白(bái)質可溶性表達,建議(yì)在10μmol/L以下(xià)濃度範圍内優化;在大(dà)腸杆菌乳糖操縱子表達系統中,無須額外(wài)加入IPTG誘導劑的自(zì)動誘導表達策略也(yě)是常見的更加溫和(hé)的誘導方式;熱誘導不用(yòng)添加外(wài)來(lái)誘導物,成本低(dī),但(dàn)是發酵過程中加熱升溫培養,細菌的生長和(hé)代謝(xiè)均加速,在一定程度上(shàng)加快(kuài)了(le)重組蛋白(bái)質的翻譯合成速度,增加蛋白(bái)質折疊負擔;因此可以嘗試在誘導時(shí)将培養溫度升高(gāo)至42℃後維持15~30 min,讓cIts857蛋白(bái)充分變構失活,解除阻遏,啓動轉錄,然後再将培養溫度降低(dī)至35℃以下(xià),降低(dī)細菌的新陳代謝(xiè)和(hé)重組蛋白(bái)質表達速度,減輕蛋白(bái)質折疊負擔;低(dī)溫誘導能(néng)夠降低(dī)大(dà)腸杆菌的新陳代謝(xiè),進而降低(dī)重組蛋白(bái)質合成速度,降低(dī)有聚集傾向的重組蛋白(bái)質折疊前體累積,一定程度上(shàng)減少包涵體形成的概率和(hé)提高(gāo)可溶性表達比例。
大(dà)腸杆菌表達宿主選擇:爲了(le)提高(gāo)蛋白(bái)質表達水(shuǐ)平,促進二硫鍵形成,提高(gāo)蛋白(bái)質正确折疊,改善蛋白(bái)質可溶性表達比例,各種類型的大(dà)腸杆菌宿主細胞被設計(jì)與改造。常見的大(dà)腸杆菌宿主包括E. coli BL21系列、Rosetta系列和(hé)Origami系列等。
表 大(dà)腸杆菌表達體系常用(yòng)宿主亞型類型 Commonly used commercial available E. coli host bacteria
| 大(dà)腸杆菌 宿主類型 |
功能(néng)應用(yòng) | 特征 | 抗性特征 |
| BL21 | 常規表達 | 非毒性蛋白(bái)的高(gāo)水(shuǐ)平表達,不能(néng)用(yòng)于由T7啓動子驅動的蛋白(bái)質表達 | 無 |
| BL21(DE3) | 含T7 RNA聚合酶,可用(yòng)于T7、lac、tac、trc及trp啓動子控制的目的基因表達 | 無 | |
| BL21Star(DE3) | RNase E基因突變失活,防止轉錄後mRNA的快(kuài)速降解 | 無 | |
| BL21(DE3) plysS | 毒性蛋白(bái)表達,稀有密碼子基因表達 | 含有表達T7溶菌酶的基因,可降低(dī)目的基因的背景表達水(shuǐ)平,但(dàn)不幹擾目的蛋白(bái)表達 | 氯黴素 |
| Rossatta (DE3) | 含6種稀有密碼子質粒(AUA、AGG、AGA、CUA、CCC、GGA),适合含稀有密碼子基因表達 | 四環素、卡那黴素 | |
| BL21 Origami B (DE3) | 含二硫鍵蛋白(bái)表達 | 有助于含二硫鍵蛋白(bái)的活性蛋白(bái)質形成 | 四環素、卡那黴素 |
| Origami 2 (DE3) | 在trxB和(hé)gor基因上(shàng)同時(shí)含有突變,利于含二硫鍵蛋白(bái)的折疊與氧化 | 四環素、鏈黴素、卡那黴素 | |
| BL21 trxB (DE3) | 擁有硫氧還蛋白(bái)還原酶突變體,利于二硫鍵在細胞質中形成,适合含二硫鍵蛋白(bái)的正确折疊和(hé)表達 | 卡那黴素 | |
| Rosetta-gami (DE3) pLysS | 二硫鍵氧化,稀有密碼子表達 | TrxB和(hé)Gor基因突變,利于含二硫鍵蛋白(bái)質正确折疊,同時(shí)含有稀有密碼子tRNA | 氯黴素、卡那黴素、鏈黴素、四環素 |
| Rosetta-gami 2(DE3) | 攜帶有TrxB和(hé)Gor基因突變,利于含二硫鍵蛋白(bái)質正确折疊,同時(shí)含有稀有密碼子tRNA | 四環素 |
胞内表達與分泌表達:通常情況下(xià),大(dà)腸杆菌表達重組異源蛋白(bái)質采用(yòng)胞内形式表達,具有表達量高(gāo)的優勢,但(dàn)是大(dà)腸杆菌高(gāo)還原性及缺乏折疊伴侶分子的胞内環境導緻部分蛋白(bái)質在胞内表達時(shí)易形成包涵體。此種情況下(xià),還可以考慮分泌表達。
細菌培養條件優化:大(dà)腸杆菌的培養環境也(yě)是影響外(wài)源蛋白(bái)質可溶性表達的關鍵因素之一,這(zhè)些(xiē)因素包括溫度、pH、微量元素等。溫度對(duì)細菌生長和(hé)重組蛋白(bái)質表達的影響是多方面的,包括細菌的生長速度、蛋白(bái)質合成速度、重組蛋白(bái)質折疊前體的聚集傾向程度、蛋白(bái)質穩定性和(hé)生物活性,以及重組蛋白(bái)質的溶解度等。綜合效益來(lái)看(kàn),降低(dī)溫度往往更有利于重組蛋白(bái)質的可溶性表達。因此從(cóng)培養條件的角度,優化培養溫度對(duì)提高(gāo)蛋白(bái)質比例影響最大(dà)。pH也(yě)是影響蛋白(bái)質表達形成的因素之一,大(dà)腸杆菌生長的最适pH在6.5~7.5,與外(wài)源蛋白(bái)質等電點相差越大(dà),所表達的蛋白(bái)質就更容易形成可溶性蛋白(bái)質。因此需要根據菌體和(hé)目的蛋白(bái)的特點選擇合适的pH,并保持培養基中pH 相對(duì)穩定。微量元素也(yě)能(néng)夠影響蛋白(bái)質的表達形式。研究表明(míng)向培養基中加入微量元素(Zn2+、Mg2+等)可以提高(gāo)目的蛋白(bái)的可溶性表達。這(zhè)可能(néng)是因爲異源蛋白(bái)質二硫鍵的形成是一個酶依賴性反應過程,向培養基中添加适量金(jīn)屬離子,能(néng)夠在一定程度上(shàng)提高(gāo)部分酶的活性,進而促進重組蛋白(bái)質折疊與穩定性。
促溶标簽融合表達:促溶标簽融合表達在增加重組蛋白(bái)質産率及提高(gāo)可溶性表達比例等方面具有重要應用(yòng)意義。常用(yòng)促溶标簽包括麥芽糖結合蛋白(bái)(MBP)、谷胱甘肽S-轉移酶(GST)、小(xiǎo)泛素樣修飾蛋白(bái)(SUMO)和(hé)硫氧還蛋白(bái)(Trx)等。
表 重組蛋白(bái)質表達常用(yòng)融合标簽類型Commonly used solubility-enhancing tags
| 融合标簽 | 大(dà)小(xiǎo)/aa | 功能(néng) | 特征 |
| MBP (Maltose-binding protein) | 396 | 防止聚集沉澱 | 極強促溶 |
| NusA (N-utilization substance) | 495 | 輔助折疊 | 促溶 |
| Trx (Thioredoxin) | 109 | 輔助二硫鍵氧化 | 改善胞内還原性 |
| SUMO (Small ubiquitin modifier) | 約100 | 促溶、輔助折疊 | 特異性蛋白(bái)酶識别(Ulp-1) |
| GST (Glutathione-S-transferase) | 211 | 促溶表達 | 形成二聚體 |
分子伴侶共表達:通過分子伴侶協助重組蛋白(bái)質折疊提升重組蛋白(bái)質可溶性表達的方式主要爲将分子伴侶基因協同插入在表達載體上(shàng),使其與目的基因共表達,應用(yòng)中常見的策略有單種分子伴侶過表達和(hé)多種伴侶系統協同過表達。
表 大(dà)腸杆菌表達體系常用(yòng)分子伴侶Commonly used chaperone family member in E. coli
| 分子伴侶家族 | 大(dà)腸杆菌體系 對(duì)應家族 |
功能(néng) | 應用(yòng) |
| HSP60 | GroEL GroES |
高(gāo)度協調和(hé)對(duì)稱變構輔助蛋白(bái)質折疊 | GroEL |
| GroES | |||
| GroEL-GroES(ELS) | |||
| HSP70 | DnaK DnaJ/GrpE |
減少錯誤折疊蛋白(bái)質的聚集并促進蛋白(bái)質水(shuǐ)解;穩定未折疊蛋白(bái)質 | DnaK |
| DnaJ | |||
| DnaK-DnaJ | |||
| DnaK-DnaJ-GrpE(KJE) | |||
| HSP90 | HptG | 減少錯誤折疊或未折疊蛋白(bái)質的聚集 | HptG |
| HSP100 | ClpA ClpB |
拆分含有錯誤折疊蛋白(bái)質的聚集體 | ClpA |
| ClpB | |||
| sHSP | IbpA IbpB |
保護熱變性蛋白(bái)質不發生不可逆聚集;結合并穩定變性蛋白(bái)質 | IbpAB |
| Trigger factor | Trigger factor | 核糖體相關伴侶 | TF |
大(dà)腸杆菌N-糖基化修飾:重組異源蛋白(bái)質在大(dà)腸杆菌中難以可溶性表達的主要因素之一在于缺乏翻譯後修飾功能(néng),其中糖基化修飾對(duì)重組異源蛋白(bái)質的穩定性和(hé)溶解性具有極大(dà)影響。在一定程度上(shàng),缺乏糖基化修飾是影響真核蛋白(bái)在大(dà)腸杆菌中可溶性表達的最主要因素。
蛋白(bái)質錯誤折疊或未折疊以及形成包涵體是大(dà)腸杆菌表達體系應用(yòng)的巨大(dà)阻礙。因此,探索可溶性表達策略對(duì)應用(yòng)大(dà)腸杆菌體系生産重組蛋白(bái)質意義重大(dà)。重組蛋白(bái)質自(zì)身的氨基酸組成、親疏水(shuǐ)性強弱、分子量大(dà)小(xiǎo)、結構複雜(zá)程度、結構折疊難易程度、二硫鍵形成與否、二硫鍵數量及重組蛋白(bái)質的合成速度等均能(néng)影響重組蛋白(bái)質在大(dà)腸杆菌表達體系中的表達形式和(hé)可溶性表達比例。因此,在大(dà)腸杆菌表達體系中實現(xiàn)更多重組異源蛋白(bái)質的可溶性與功能(néng)性表達仍然有諸多挑戰,未來(lái)還将從(cóng)以下(xià)幾個方面持續改進:其一,不斷完善重組異源蛋白(bái)質在胞内的結構折疊輔助體系,包括分子伴侶、融合伴侶等的設計(jì)與開(kāi)發;其二,進一步優化提高(gāo)在原核宿主系統中的二硫鍵氧化與正确形成能(néng)力;其三,持續改善大(dà)腸杆菌表達體系的糖基化能(néng)力和(hé)形式,包括糖基化效率和(hé)糖基化糖型優化等。
參考文(wén)獻:
- Narciandi R E , Rivera J M ,D. Rodríguez.Effect of induction strategy on the expression of different recombinant protein synthesized in Escherichia coli under the control of tryptophan promoter[J]. 2016.
- Thomas J G, Ayling A, Baneyx F.Molecular chaperones, folding catalysts, and the recovery of active recombinant proteins from E. coli Applied Biochemistry and Biotechnology, 1997, 66(3): 197-238.
- de Marco A, Deuerling E, Mogk A, et al.Chaperone-based procedure to increase yields of soluble recombinant proteins produced in E. coli BMC Biotechnology, 2007, 7: 32-32.
- MIAO Zhao-yue, DU Le, WANG Jia-qi, CHEN Zi-jie, HUANG Jing-bei, CHEN Qie-xin, ZOU Pei-xuan, HAN Xiao, ZHANG Chun. Soluble Expression Strategies for Production of Recombinant Proteins in Escherichia coli. Journal of Chinese Biotechnology, 2023, 43(9): 33-45 doi:10.13523/j.cb.2305048

 聯系我們
聯系我們





