抗體藥物偶聯物(antibody-drug conjugate, ADC)是一類通過連接子将細胞毒性藥物連接到(dào)單克隆抗體的靶向生物制劑,将單克隆抗體作(zuò)爲載體将小(xiǎo)分子細胞毒性藥物以靶向的方式高(gāo)效地運輸至目标腫瘤細胞中。腫瘤特異性抗體使ADC藥物可以選擇性遞送小(xiǎo)分子細胞毒性藥物,在減少小(xiǎo)分子細胞毒性藥物脫靶作(zuò)用(yòng)的同時(shí),保留了(le)其抗腫瘤特性,有效地提高(gāo)了(le)抗腫瘤治療的效益風(fēng)險比。因此,近年來(lái)ADC藥物一直是腫瘤精準治療領域的熱門(mén)研究方向之一。截至2022年9月30日,已有14種ADC藥物在全球範圍内獲批用(yòng)于臨床(包括血液系統腫瘤和(hé)實體瘤領域),其中,美(měi)國獲批12種,歐盟獲批10種,我國獲批4種,日本獲批4種(表1 )。此外(wài)還有百餘種ADC藥物的臨床研究正在開(kāi)展中。
| 藥物名稱 | 靶點 | 細胞毒性藥物 | 适應證 | 獲得批準情況 |
| 吉妥珠單抗 | CD33 | 刺孢黴素 | CD33陽性急性髓性白(bái)血病 | 2000年獲得批準,2010年撤銷上(shàng)市,2017年于美(měi)國重新獲得批準,2018年于歐盟獲得批準 |
| 維布妥昔單抗 | CD30 | 甲基澳瑞他(tā)汀E | 經典型霍奇金(jīn)淋巴瘤,系統性間變性大(dà)細胞淋巴瘤或CD30陽性外(wài)周T細胞淋巴瘤,原發CD30陽性皮膚間變性大(dà)細胞淋巴瘤或CD30陽性的蕈樣肉芽腫 | 2011年于美(měi)國獲得批準,2012年于歐盟獲得批準,2020年于中國獲得批準 |
| 恩美(měi)曲妥珠單抗 | HER-2 | 美(měi)坦辛衍生物 | (1)HER-2陽性晚期乳腺癌:用(yòng)于既往接受過曲妥珠單抗和(hé)紫杉類藥物單獨或聯合治療,并滿足以下(xià)條件之一:既往接受過針對(duì)轉移性疾病治療;在輔助治療期間複發;完成輔助治療後6個月内出現(xiàn)複發;(2)HER-2陽性早期乳腺癌:用(yòng)于在基于紫杉類藥物和(hé)曲妥珠單抗的新輔助治療後殘留浸潤性病竈患者的輔助治療 | 2013年于美(měi)國獲得批準,2013年于歐盟獲得批準,2013年于日本獲得批準,2021年于中國獲得批準,2019年于美(měi)國獲得批準,2020年于中國獲得批準 |
| 奧英妥珠單抗 | CD22 | 刺孢黴素 | 成人複發或難治性CD22陽性前體B細胞急性淋巴細胞白(bái)血病 | 2017年于美(měi)國獲得批準 |
| Polatuzumab vedotin | CD79b | 甲基澳瑞他(tā)汀E | 聯合苯達莫司汀和(hé)利妥昔單抗治療複發或難治性彌漫大(dà)B細胞淋巴瘤 | 2019年于美(měi)國獲得批準 |
| Enfortumab vedotin | Nectin-4 | 甲基澳瑞他(tā)汀E | (1)既往接受過PD-1或PD-L1抑制劑和(hé)含鉑化療的局部晚期或轉移性尿路上(shàng)皮癌;(2)不适合順鉑治療且既往接受過一線或多線治療的局部晚期或轉移性尿路上(shàng)皮癌;(3)既往接受過PD-1或PD-L1抑制劑治療且不适合順鉑治療的局部晚期或轉移性尿路上(shàng)皮癌 | 2019年于美(měi)國獲得批準,2021年于日本獲得批準,2021年于美(měi)國獲得批準,2022年于歐盟獲得批準 |
| Trastuzumab deruxtecan | HER-2 | Exatecan衍生物 | (1)用(yòng)于治療接受過2種或2種以上(shàng)抗HER-2治療方案的無法切除或轉移性HER-2陽性乳腺癌成年患者;(2)用(yòng)于既往在轉移階段接受過至少1種抗HER-2治療方案或在接受抗HER-2新輔助或輔助療法期間以及之後6個月内出現(xiàn)疾病複發的不可切除或轉移性HER-2陽性乳腺癌成人患者;(3)用(yòng)于治療既往在轉移階段接受過治療的不可切除或轉移性HER-2低(dī)表達(IHC 1+或IHC 2+/ISH-)成人乳腺癌患者;(4)已接受過曲妥珠單抗治療的局部晚期或轉移性HER-2陽性胃或胃食管交界腺癌患者;(5)用(yòng)于治療既往接受過全身治療的HER-2敏感突變的不可切除或轉移性非小(xiǎo)細胞肺癌成人患者;(6)用(yòng)于治療化療進展的不可手術晚期或複發性HER-2陽性胃癌患者 | 2019年于美(měi)國獲得批準,2020年于日本獲得批準,2021年于歐盟獲得批準,2022年于美(měi)國獲得批準,2022年于歐盟獲得批準,2022年于美(měi)國獲得批準,2023年于中國獲得批準,2021年于美(měi)國獲得批準,2022年于美(měi)國獲得批準,2022年于歐盟獲得批準 |
| 戈沙妥珠單抗 | TROP-2 | SN-38,伊立替康的活性代謝(xiè)産物 | (1)用(yòng)于既往至少接受過2種系統治療(其中至少1種治療針對(duì)轉移性疾病)的不可切除的局部晚期或轉移性三陰性乳腺癌成人患者;(2)接受過含鉑化療和(hé)PD-(L)1抑制劑治療的局部晚期或轉移性尿路上(shàng)皮癌成年患者;(3)用(yòng)于既往接受過内分泌治療且≥2線系統治療(針對(duì)轉移性疾病)的HR陽性、HER-2陰性的不可切除的局部晚期或轉移性乳腺癌患者 | 2020年于美(měi)國獲得批準,2021年于歐盟獲得批準,2022年于中國獲得批準,2021年于美(měi)國獲得批準,2023年于美(měi)國獲得批準 |
| Moxetumomab pasudotox | CD22 | PE38 | 成人複發或難治性毛細胞白(bái)血病,既往接受過至少二線治療 | 2018年于美(měi)國獲得批準 |
| Belantamab mafodotin | BCMA | 甲基澳瑞他(tā)汀F | 用(yòng)于治療既往已接受過至少4種療法(包括抗CD38單抗、蛋白(bái)酶體抑制劑和(hé)免疫調節劑)的複發或難治性多發性骨髓瘤成人患者 | 2020年于美(měi)國獲得批準,2020年于歐盟獲得批準 |
| Cetuximab sarotalocan | EGFR | IRDye700DX | 不可切除的局部晚期或複發性頭頸癌 | 2020年日本獲得批準 |
| Loncastuximab tesirine | CD19 | PBD | 治療已接受過至少2種系統療法的複發或難治性大(dà)B細胞淋巴瘤成人患者,包括彌漫性大(dà)B細胞淋巴瘤、低(dī)級别B淋巴瘤轉化的大(dà)B細胞淋巴瘤和(hé)高(gāo)級别B細胞淋巴瘤 | 2021年于美(měi)國獲得批準 |
| 維迪西妥單抗 | HER-2 | 甲基澳瑞他(tā)汀E | (1)用(yòng)于至少接受過2種系統化療的HER-2過表達局部晚期或轉移性胃癌(包括胃食管結合部腺癌)患者的治療;(2)用(yòng)于既往接受過含鉑化療且HER-2過表達即免疫組化檢查結果爲HER-2 2+或3+的局部晚期或轉移性尿路上(shàng)皮癌 | 2021年于中國獲得批準,2022年于中國獲得批準 |
| Tisotumab vedotin | TF-011 | 甲基澳瑞他(tā)汀E | 用(yòng)于在化療期間或化療後出現(xiàn)疾病進展的複發或轉移性成人宮頸癌患者 | 2021年于美(měi)國獲得批準 |
ADC藥物定義
ADC藥物是一類通過特定的連接子将特異性的單克隆抗體與高(gāo)殺傷性的細胞毒性藥物偶聯起來(lái)的靶向生物制劑。ADC藥物通常應包含以下(xià)3個組分:高(gāo)特異性和(hé)親和(hé)力的抗體,高(gāo)穩定性的連接子,高(gāo)效的小(xiǎo)分子細胞毒藥物。
ADC藥物臨床應用(yòng)
ADC藥物是一類具有獨特作(zuò)用(yòng)機制的抗腫瘤創新藥,既往的臨床數據顯示ADC藥物在腫瘤治療中具有很(hěn)好(hǎo)的療效和(hé)安全性,本共識旨在推進ADC藥物的臨床應用(yòng)規範和(hé)安全,讓更多的腫瘤患者獲益。
多學科管理(lǐ)
ADC藥物的不良反應取決于非腫瘤組織靶标的生理(lǐ)功能(néng)和(hé)表達情況、連接子的性質、細胞毒性藥物的數量和(hé)類型等多種因素。因此,針對(duì)每種ADC藥物應密切關注特異性的不良反應,并給予對(duì)症處理(lǐ),必要時(shí)應邀請(qǐng)相關學科專家會(huì)診,降低(dī)不良反應對(duì)患者預後和(hé)生活質量的影響。
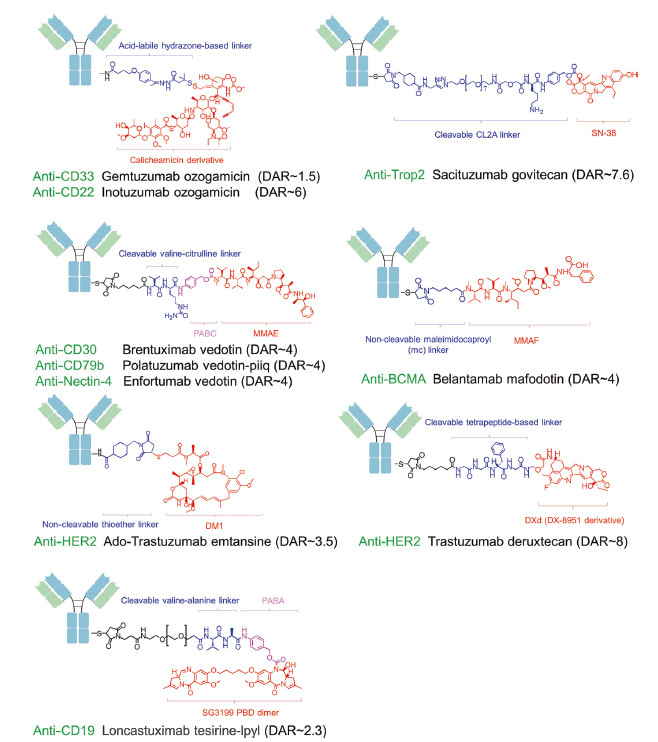
随着抗體工(gōng)程技術的不斷優化,各種新型治療性抗體藥物相繼用(yòng)于癌症的治療,包括抗體偶聯藥物(ADC)、雙特異性/多特異性抗體、免疫細胞因子、抗體片段(例如Fabs、scFvs和(hé)VHH結構域)和(hé)非IgG支架蛋白(bái)。目前,經批準的ADC藥物的靶抗原通常是在癌細胞中過表達的特異性蛋白(bái),包括實體瘤中的HER2、trop2、nectin4和(hé)EGFR,以及血液惡性腫瘤中的CD19、CD22、CD33、CD30、BCMA和(hé)CD79b。在腫瘤學和(hé)免疫學基礎研究的推動下(xià),ADC靶抗原的選擇逐漸從(cóng)傳統的腫瘤細胞抗原擴展到(dào)腫瘤微環境中的靶點,例如基質和(hé)脈管系統。臨床前和(hé)臨床研究不斷湧現(xiàn)出的新證據表明(míng),新生血管系統、内皮下(xià)細胞外(wài)基質和(hé)腫瘤基質的成分可能(néng)是ADC藥物開(kāi)發的有價值的靶抗原。
在ADC藥物的開(kāi)發中需要面臨很(hěn)多挑戰,例如抗體藥物的發現(xiàn)與篩選、藥物的有效性、與ADC藥物相關的毒性等。普健生物作(zuò)爲武漢國家生物産業基地指定的唯一光谷抗體發現(xiàn)與篩選公共服務平台,在蛋白(bái)抗體領域擁有超過15年的技術經驗積累,基于完善的五大(dà)蛋白(bái)表達系統和(hé)三大(dà)核心技術路線,能(néng)提供從(cóng)抗原制備,到(dào)抗體生産,标記,檢測,測序一站(zhàn)式服務,加速抗體藥物研發進程。
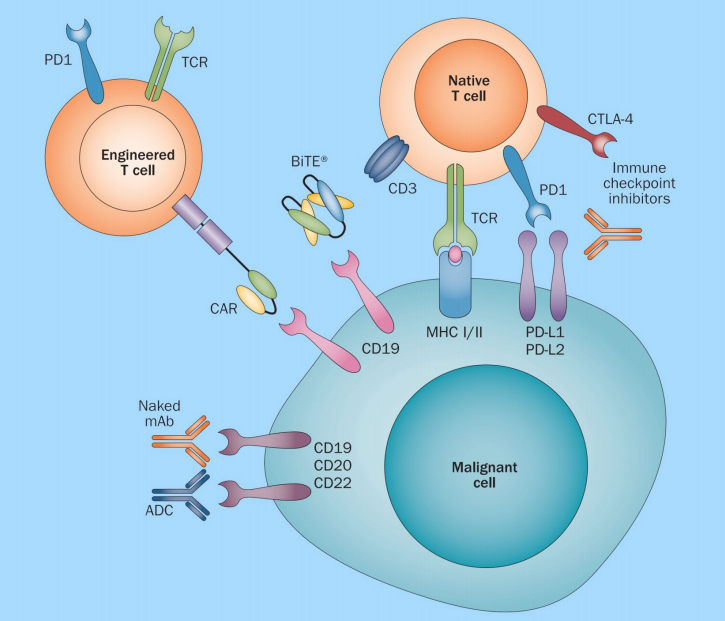
ADCs的出現(xiàn)爲許多類型的癌症提供了(le)一種有希望的治療方法。随着越來(lái)越多的ADCs進入臨床試驗,該行業正在逐漸從(cóng)傳統的技術逐漸轉向更新和(hé)更強大(dà)技術以開(kāi)發這(zhè)種複雜(zá)産品。

 聯系我們
聯系我們





