棕榈酰蛋白(bái)質硫酯酶1 (palmitoyl protein thioesterase 1,PPT1)是一種溶酶體酶,具有對(duì)蛋白(bái)質行使去棕榈酰化修飾的功能(néng),在調控細胞器(如溶酶體、線粒體)功能(néng)、脂質代謝(xiè)和(hé)Ca2+轉運等方面具有重要作(zuò)用(yòng)。PPT1在神經系統疾病和(hé)癌症的發生發展中發揮了(le)重要的作(zuò)用(yòng),然而其調控作(zuò)用(yòng)機制仍未被完全闡明(míng)。
棕榈酰蛋白(bái)質硫酯酶1(palmitoyl protein thioesterase 1,PPT1)在牛腦(nǎo)細胞質的研究中首次發現(xiàn)并被純化出來(lái),PPT1主要定位在溶酶體中,在細胞中行使去棕榈酰化的功能(néng)。PPT1可以去棕榈酰化GAP43 (growth associated protein 43)、PSD-95 (postsynaptic density protein 95)等多個蛋白(bái),影響溶酶體的功能(néng)和(hé)穩态,表明(míng)PPT1在維持溶酶體正常生理(lǐ)功能(néng)中具有重要作(zuò)用(yòng)。
PPT1與疾病的發生發展有着密切的關系。嬰兒神經元蠟樣脂褐素沉積症(infantile neuronal ceroid lipofuscinosis,INCL),也(yě)被稱爲嬰兒巴頓病,是一種罕見的隐性遺傳神經退行性疾病,患有INCL的嬰兒一般在18個月左右出現(xiàn)視(shì)覺運動缺陷、認知(zhī)障礙、癫痫發作(zuò)等症狀。研究人員發現(xiàn)該疾病是由于神經元細胞内PPT1基因突變導緻PPT1功能(néng)受損,細胞内類脂質不能(néng)被及時(shí)分解,在神經元細胞内沉積,最終導緻神經元功能(néng)障礙和(hé)死亡,造成INCL。此外(wài),PPT1與腫瘤的發生發展也(yě)密切相關,在多種腫瘤中都存在PPT1過表達的情況,且高(gāo)表達的PPT1與腫瘤惡性程度呈正相關。研究表明(míng)抑制PPT1的表達或活性,可以抑制腫瘤細胞的增殖和(hé)侵襲,靶向PPT1對(duì)多種腫瘤有較強的治療效果。以上(shàng)研究表明(míng),PPT1是治療INCL和(hé)癌症的有效靶點,因此,研究PPT1在疾病中的作(zuò)用(yòng)及機制、研發靶向PPT1的藥物是未來(lái)神經性疾病和(hé)腫瘤治療的重要方向之一。
PPT1基因定位于人類1号染色體短臂3區(qū)4帶2亞帶(1p34.2),全長25751 bp。PPT1有19個轉錄本,其中最常見的轉錄本由9個外(wài)顯子組成,外(wài)顯子1~8長約70~140 bp,被長短不一的内含子間隔開(kāi)來(lái),最大(dà)的外(wài)顯子9位于靠近3'端的位置。自(zì)然界中存在220個PPT1的直系同源物,在不同的模式生物(秀麗(lì)隐杆線蟲Caenorhabditis elegans、拟南芥 Arabidopsis thaliana等)中都能(néng)找到(dào)PPT1的同源基因。
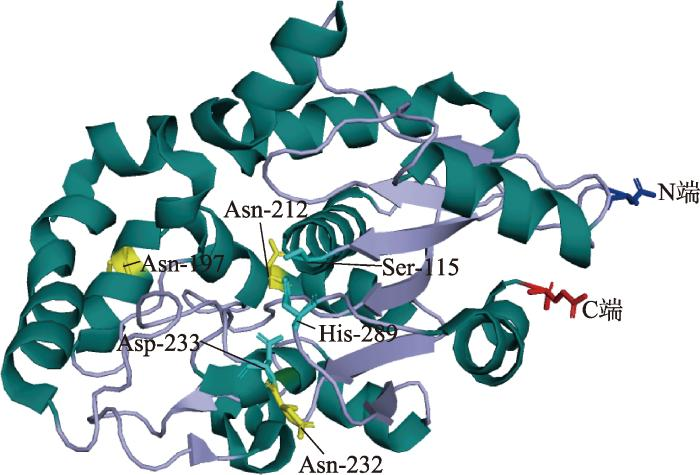
PPT1蛋白(bái)由306個氨基酸組成,分子量約35 kDa,PPT1二聚體采用(yòng)α/β折疊,包含N端α螺旋、β折疊區(qū)、C端α螺旋等多個重要的結構。N端α螺旋位于PPT1分子的一側,與另一個亞基的β折疊區(qū)域相互作(zuò)用(yòng),負責PPT1的組裝;β折疊區(qū)包含多個β片層,形成PPT1的主要結構框架;C端α螺旋與連接區(qū)域一起形成了(le)PPT1的另一側,該側上(shàng)的活性位點負責棕榈酰輔酶A的水(shuǐ)解。通過多波長反常衍射相位法(multiwavelength anomalous diffraction,MAD)測定PPT1的晶體結構,發現(xiàn)PPT1晶體結構中的活性位點是由Ser115- His289-Asp233組成的催化三聯體,Ser115通過其羟基與脂質酰基結合,形成酯鍵從(cóng)而水(shuǐ)解酰基,Asp233的負電荷與Ser115的羟基形成氫鍵,同時(shí)能(néng)在Ser115和(hé)His289之間提供催化作(zuò)用(yòng);His289的環氨基和(hé)Ser115的羟基能(néng)夠在催化反應中形成過渡态,穩定其催化結構。糖基化是PPT1翻譯後修飾的形式之一,此前在非神經元細胞中的研究已證明(míng),PPT1的3個N-糖基化位點的突變會(huì)顯著降低(dī)其酶活性;研究發現(xiàn),PPT1特定的氨基酸殘基位點(天冬酰胺197和(hé)232位點)N-糖基化增強了(le)其形成複合物的能(néng)力。蛋白(bái)印迹分析表明(míng),PPT1蛋白(bái)主要以二聚體或三聚體的形式存在,在去糖基化過程中演變成單個大(dà)小(xiǎo)29 kDa的蛋白(bái)質。
嬰兒神經元蠟樣脂褐素沉着症(INCL)是一種嚴重的神經退行性疾病,INCL通常在嬰兒期開(kāi)始發作(zuò),表現(xiàn)爲進行性的神經系統退化,這(zhè)種疾病的典型症狀是智力和(hé)運動能(néng)力發育遲緩、癫痫發作(zuò)、視(shì)力喪失、肌張力增高(gāo)、肌肉萎縮以及認知(zhī)和(hé)行爲問題等,INCL病理(lǐ)的一個标志是脂褐素的進行性積累,最顯著地存在于神經系統中,也(yě)存在于其他(tā)一些(xiē)組織中。引起INCL的PPT1突變分布在整個編碼區(qū),主要是第4外(wài)顯子活性位點附近R122W(Arg122Trp)突變和(hé)第5外(wài)顯子R151*(Arg151STOP)突變,導緻PPT1結構的明(míng)顯改變,從(cóng)而影響PPT1的功能(néng),導緻溶酶體無法有效降解儲存在神經細胞中的脂褐素,最終導緻這(zhè)些(xiē)儲存物在腦(nǎo)中沉積引發INCL。
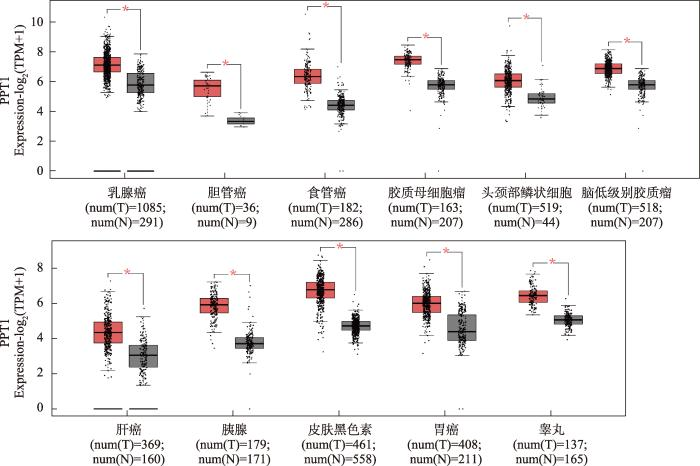
已有的研究表明(míng),PPT1在腫瘤發生及進展中發揮重要作(zuò)用(yòng)。目前關于PPT1的研究主要集中在PPT1在不同腫瘤中的表達與腫瘤生長、進展以及預後之間的關系,根據TCGA數據庫分析,與配對(duì)的正常組織相比,PPT1在11種腫瘤中表達水(shuǐ)平顯著升高(gāo),并與腫瘤的病理(lǐ)分型、惡性程度、侵襲性和(hé)轉移等都有相關性。PPT1異常表達導緻mTOR信号通路的過度激活,這(zhè)種過度激活通過增加蛋白(bái)合成、抑制自(zì)噬和(hé)加快(kuài)細胞周期進程等方式來(lái)促進腫瘤細胞的生長和(hé)增殖。研究表明(míng),在口腔鱗狀細胞癌(OSCC)使用(yòng)erianin (一種天然的聯苄基化合物,具有抗癌作(zuò)用(yòng))處理(lǐ)之後,觀察到(dào)PPT1的表達降低(dī),mTOR與RHEB (ras homolog enriched in brain)的相互作(zuò)用(yòng)減少,mTOR的磷酸化減弱,這(zhè)些(xiē)結果提示PPT1可能(néng)通過調節mTOR與RHEB的相互作(zuò)用(yòng)從(cóng)而調控mTOR通路。
總之,PPT1在疾病發生發展中發揮重要作(zuò)用(yòng),PPT1的突變或者缺失會(huì)影響溶酶體的功能(néng)并造成脂褐素等物質在神經細胞中積累,最終導緻神經系統的退化和(hé)損傷,引發神經退行性疾病,如INCL等。PPT1過表達會(huì)保護細胞免于細胞死亡,促進腫瘤發生,而反義PPT1增加細胞死亡抑制腫瘤的發生。
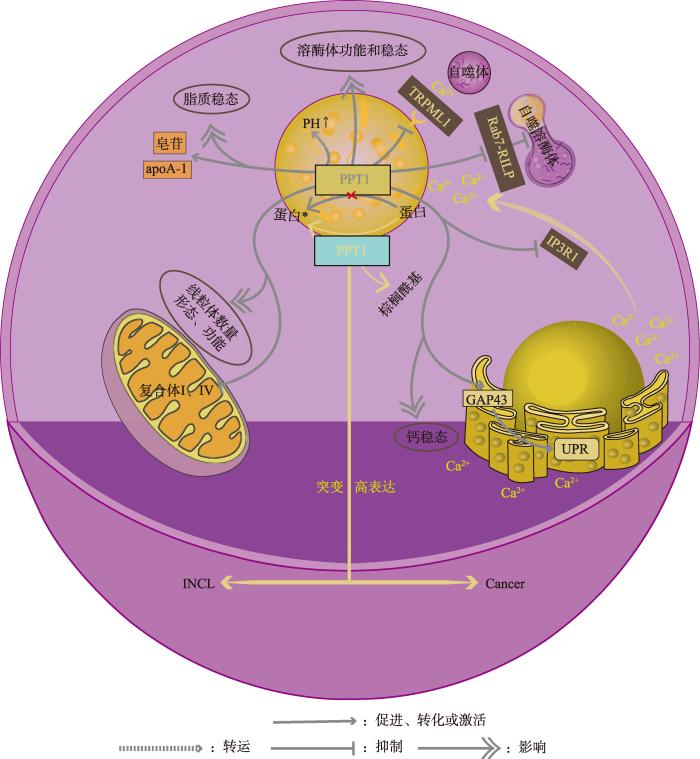
迄今爲止,對(duì)于PPT1在胞内的轉運、代謝(xiè)、相互作(zuò)用(yòng)等一系列生理(lǐ)生化過程的研究仍有限,從(cóng)已有的研究來(lái)看(kàn),PPT1不僅在維持細胞内環境穩态方面發揮重要作(zuò)用(yòng),且在神經退行性疾病以及腫瘤發生發展過程中也(yě)起到(dào)了(le)重要作(zuò)用(yòng)。但(dàn)對(duì)于PPT1的具體調控機制以及靶向PPT1的酶激活劑、抑制劑等方面的研究還有待進一步的加強。PPT1介導的去棕榈酸化及溶酶體功能(néng)調控在疾病,尤其是腫瘤發生發展中的功能(néng)及機制還需進一步研究,利用(yòng)小(xiǎo)鼠等模型動物探讨PPT1突變介導的溶酶體功能(néng)失調在不同腫瘤發生中的作(zuò)用(yòng)及機制是重要的研究方向之一。基于PPT1在腫瘤中高(gāo)表達并促進其發生發展的重要作(zuò)用(yòng),因此未來(lái)開(kāi)發靶向PPT1的幹預措施,能(néng)爲疾病的治療提供可靠的策略。
參考文(wén)獻
- Bellizzi JJ, Widom J, Kemp C, Lu JY, Das AK, Hofmann SL, Clardy J.The crystal structure of palmitoyl protein thioesterase 1 and the molecular basis of infantile neuronal ceroid lipofuscinosis.Proc Natl Acad Sci USA, 2000, 97(9): 4573-4578.
- Mondal A, Appu AP, Sadhukhan T, Bagh MB, Previde RM, Sadhukhan S, Stojilkovic S, Liu AY, Mukherjee AB.Ppt1-deficiency dysregulates lysosomal Ca(++) homeostasis contributing to pathogenesis in a mouse model of CLN1 disease.J Inherit Metab Dis, 2022, 45(3): 635-656.
- Xinyi Zhou, Dong Chang, Huangying Xu, Ruiqi Guan, Chenghao Yan, Qiuyuan Yin, Jianwei Sun. Progress on lysosomal PPT1-mediated regulation of cellular homeostasis and pathogenesis. Hereditas(Beijing)[J], 2023, 45(10): 874-886 doi:10.16288/j.yczz.23-186

 聯系我們
聯系我們





