抗體(Antibody)又被稱爲免疫球蛋白(bái)(Immunoglobulins,Ig),是機體在通過免疫原刺激後,體内的B細胞分化成能(néng)夠與相應的抗原結合的免疫球蛋白(bái)。但(dàn)是我們需要注意一個說法,免疫球蛋白(bái)不一定多具備抗體活性,而抗體則都是免疫球蛋白(bái)。下(xià)面,普健生物和(hé)大(dà)家具體聊聊有關抗體的結構。
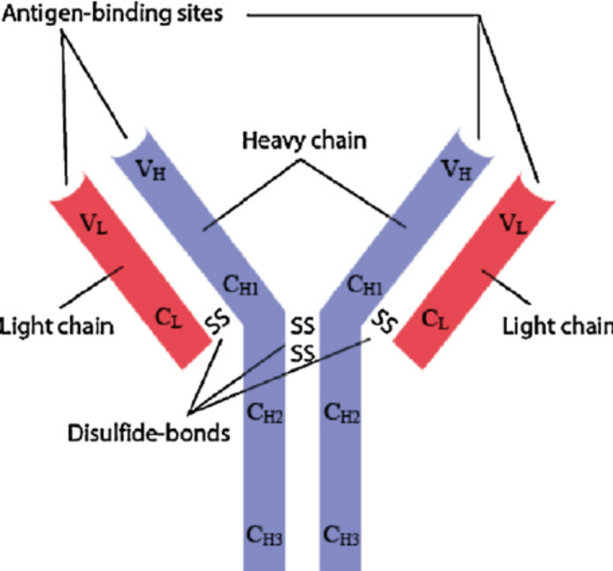
總的來(lái)說,抗體是機體非常複雜(zá)的分子,可以特異性地識别不同的抗原,也(yě)正因爲這(zhè)個原因,使得其決定了(le)抗體的多樣性。
常見的抗體一般四條多肽鏈組成,其中兩條分子量相對(duì)較大(dà)的重鏈(heavy chain,H鏈,相對(duì)分子質量爲55000或70000),以及擁有兩條輕鏈(light chain,L鏈,相對(duì)分子量爲24000)。
1、抗體的輕重鏈結構
抗體一般分爲重鏈、輕鏈以及在兩條鏈之間的二硫鍵,輕重鏈都含有一系列重複的、同源性的單元,而每個單元大(dà)約包含110個氨基酸殘基,而且它們獨立折疊成的球形形狀,因此也(yě)被稱爲球蛋白(bái)功能(néng)區(qū)。
因爲氨基酸組成的排列順序以及二硫鍵位置和(hé)數量的不同,使得其抗原性也(yě)是各不相同。因此,我們将重鏈分爲五類:γ、α、μ、δ、和(hé)ε,對(duì)應的免疫球蛋白(bái)爲IgG、 IgA、 IgM、IgD和(hé)IgE;而輕鏈大(dà)約爲重鏈的一半,大(dà)約由214個氨基酸殘基組成,一般不含碳水(shuǐ)化合物。輕鏈共有兩型:kappa(κ)與lambda(λ),同一個天然Ig分子上(shàng)輕鏈的類型總是相同的。
2、抗體的可變區(qū)和(hé)不可變區(qū)
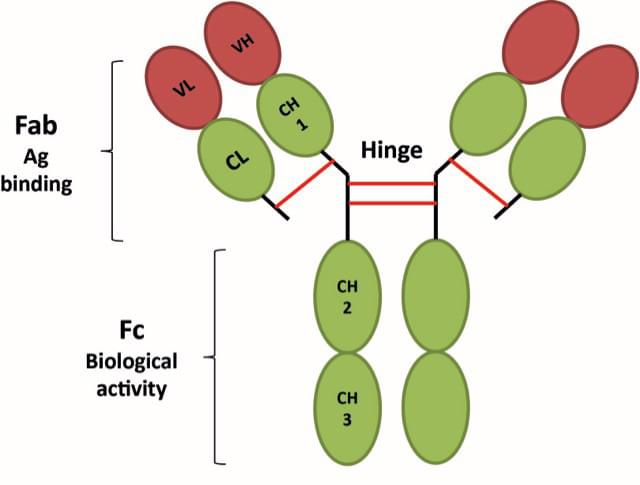
不可變區(qū):抗體恒定區(qū)域位于H鏈靠近C端的3/4或4/5(約從(cóng)119位氨基酸至C末端) 和(hé)L鏈靠近C端的1/2(約含105個氨基酸殘基)區(qū)域。抗體重鏈恒定區(qū)分爲CH1,CH2和(hé)CH3,其中CH3區(qū)域涉及到(dào)細胞膜表面受體結合,CH2涉及補體激活途徑,是補體結合位點。通常Fc融合表達蛋白(bái)(重組蛋白(bái)表達),能(néng)夠直接、定向的将目的蛋白(bái)分子作(zuò)用(yòng)于靶細胞表面依賴于融合抗體Fc片段特性,且Fc片段能(néng)夠增加某些(xiē)目的蛋白(bái)在機體内部的穩定性,延長半衰期。
可變區(qū):H鏈可變區(qū)約含118個氨基酸殘基和(hé)L鏈可變區(qū)約含108~111個氨基酸殘基。可變區(qū)是抗體結合抗原的位置,其氨基酸的組成和(hé)排列決定抗體的抗原結合特異性。可變區(qū)存在一些(xiē)氨基酸能(néng)夠高(gāo)頻變化組合的區(qū)域,這(zhè)些(xiē)區(qū)域稱爲超變區(qū)(hypervariable region,HVR),超變區(qū)又稱爲互補決定區(qū)(complementarity-determining region, CDR),超變區(qū)決定了(le)抗體的獨特型(抗獨特型抗體表達)。可變區(qū)中非HVR部位的氨基酸組成和(hé)排列相對(duì)比較保守,稱爲骨架區(qū)(framework region,FR區(qū))。VL中的CDR有三個,通常分别位于第24~34,89~97位氨基酸殘基,其中CDR3超變程度更高(gāo),抗體的特異性和(hé)親和(hé)力成熟主要涉及到(dào)該區(qū)域的改造。
總的來(lái)說,抗體的結構并沒有我們想象之中的那麽複雜(zá),我們隻要将其主要的幾個結構部位了(le)解清楚,那麽配合一些(xiē)藥劑的使用(yòng),就能(néng)獲得我們所需要的抗體。普健生物爲廣大(dà)用(yòng)戶提供專業的抗體制備及抗體定制服務,如果您有相關需求,歡迎來(lái)電咨詢。

 聯系我們
聯系我們





